“La luz de la fisiopatología, enfrenta una nueva prueba de concepto, anticoagulación sin evidencia o no” La medicina enfrenta grandes retos frente a lo desconocido, COVID-19 es la demostración; sin embargo, la demanda por adquirir conocimiento y emplearlo en intervenciones terapéuticas nos ha llevado a aplicar fármacos que no tienen sustento en evidencia científica, basándonos
“La luz de la fisiopatología, enfrenta una nueva prueba de concepto, anticoagulación sin evidencia o no”
La medicina enfrenta grandes retos frente a lo desconocido, COVID-19 es la demostración; sin embargo, la demanda por adquirir conocimiento y emplearlo en intervenciones terapéuticas nos ha llevado a aplicar fármacos que no tienen sustento en evidencia científica, basándonos en hipótesis que pretenden explicar su fisiopatología. Si aprendemos del pasado y de esta enfermedad, la intuición y el sentido común, no son suficientes para explicar procesos biológicos tan complejos; es una de las lecciones que nos deja COVID-19.
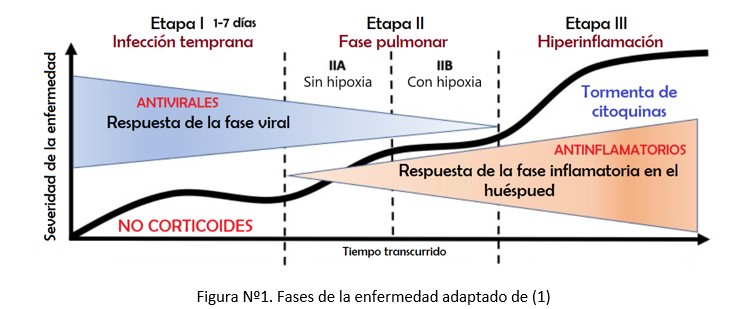
Desde un inicio, uno de los aspectos más relevantes en esta patología; desde la tentativa, ahora adoptadas las fases de la enfermedad; se centró en el componente inflamatorio (1) (Figura Nº1).
El paso del tiempo y la descripción de las complicaciones trombóticas evidenciadas en pacientes críticos que se asocian a la alta mortalidad, centraron el interés en un nuevo escenario, la coagulopatía; de ahora en adelante nos referiremos como coagulopatía asociada a COVID-19 (CAC).
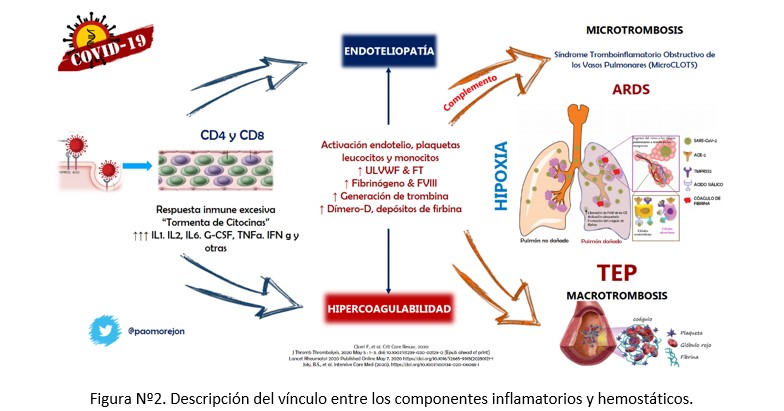
Desde los primeros reportes, niveles elevados de dímero-D repetitivamente lo encontrábamos como característica particular, hasta el 45% de pacientes lo presentan, siendo utilizado como marcador de severidad y convirtiéndose en un factor independiente de mortalidad (2–5); pacientes con valores de más de 1000 ng/mL tienen incrementado 20 veces el riesgo de muerte comparado con pacientes con menor valor de dímero-D (4). Otro de los hallazgos de alteraciones reportadas con frecuencia desde un inicio fueron el incremento de productos de degradación de la fibrina (PDF), su evaluación basal y longitudinal al igual que el dímero-D, sumado a bajos niveles de fibrinógeno y de antitrombina III al ingreso han sido asociados con mayor riesgo de muerte (6); esto se ha constituido en el punto de partida para el interés particular en la CAC. Los caminos por los cuáles la infección por SARS-CoV-2 lleva a trombosis micro y macrovascular son múltiples, desde la respuesta inflamatoria exagerada o tormenta de citoquinas con activación leucocitaria, del endotelio y las plaquetas que resultan en un incremento del factor tisular, activación de la cascada de la coagulación, generación de trombina y fibrina, con fibrinólisis limitada, vasoconstricción hipóxica y los efectos propios del virus que generan activación celular. (Figura Nº2).
Coagulopatía por SARS-CoV-2: ¿Qué sabemos?
A pesar que la literatura crece de manera abrumadora, los complejos mecanismos fisiopatológicos de la CAC no son del todo comprendidos. Es importante partir de la premisa, tanto la inflamación como la coagulación son mecanismos esenciales de defensa, su respuesta será proporcional a la enfermedad y por ende, esta se verá asociada con peores resultados (7).
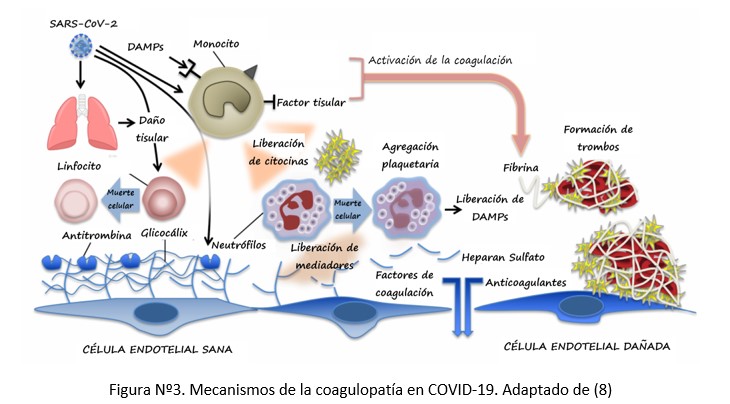
La hipótesis predominante es que la activación del sistema inflamatorio activa la cascada de la coagulación, similar a lo descripto en otras formas de sepsis; en este aspecto varios estudios han demostrado que los dos sistemas están conectados y se refuerzan mutuamente. Tanto los factores de la coagulación como las plaquetas son inmunomoduladores, es decir, poseen funciones proinflamatorias independientes de sus efectos hemostáticos (7).
Por otro lado, la reacción inflamatoria exagerada, también estimula la expresión de factor tisular en monocitos, macrófagos y células endoteliales, lo que permite el inicio de la cascada de la coagulación. Es decir, la endoteliopatía y la hipercoagulabilidad son el resultado de los cambios inflamatorios/hemostáticos de manera vinculante y no excluyente. En esta interacción, el complemento parece tener un rol fundamental, su activación perpetúa el daño endotelial, la inflamación y la formación de trombos, coagulación intravascular con lo cual contribuiría al daño orgánico descripto en esta enfermedad, describiéndose que el bloqueo de la vía final del complemento podría ser una diana terapéutica (9–11).
Si bien las alteraciones del dímero-D y productos de degradación de la fibrina dieron la pauta para indagar en este campo, con respecto a otros parámetros se ha evidenciado que la mayoría de pacientes tiene un tiempo de protrombina (TP) normal o ligeramente prolongado, el tiempo parcial de tromboplastina activado (TTPa) normal o ligeramente bajo, sin que sean asociados a la severidad de la enfermedad (2,4,12).
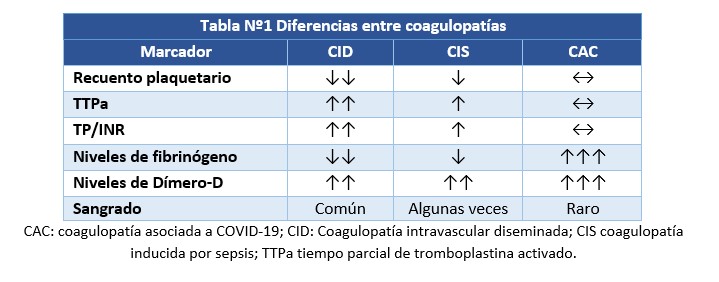
Con los reportes iniciales se consideró nos enfrentábamos a la ya conocida, coagulopatía intravascular diseminada (CID) partiendo de la coagulopatía inducida por sepsis (CIS), diferencias la separan de estas entidades, pero mantienen un factor común, la inflamación. En la CID el recuento plaquetario, el TP prolongado se correlacionan con la severidad y mortalidad en sepsis, no así los PDF ni los niveles de fibrinógeno como ocurre en CAC. Al menos en estadíos finales de COVID-19 los pacientes no presentan CID “típica”, básicamente el recuento plaquetario y la concentración de fibrinógeno no están significativamente disminuidos a pesar del marcado incremento del dímero-D. Además, cabe mencionar, que únicamente el 20% de pacientes en UCI con COVID-19 reunió criterios de CIS (6,8). Por lo que es posible que la progresión de CIS a CID no necesariamente ocurra. Otra de las alteraciones que si se relaciona con sepsis son los niveles de formas multiméricas ultra grandes del factor de von Willebrand, inversamente se correlacionan con los niveles plasmáticos de ADAMTS-13 una metaloproteasa implicada en la escisión de estas formas. Niveles bajos de la ADAMTS-13 con altos niveles de FVW pueden tener un rol importante en la tendencia protrombótica descripta en COVID-19 (13).
Podemos inferir que la falta de consumo de plaquetas y de factores de la coagulación, el primero de ellos el fibrinógeno, la muy baja incidencia de sangrado y principalmente el compromiso de la microcirculación pulmonar que lleva a una microangiopatía localizada, son características propias de esta nueva entidad; CAC no es una coagulopatía de consumo, lo que claramente la diferencia de la CID/CIS (14–17) (Tabla Nº1).
Otras observaciones por tromboelastografía, sugieren estados hipercoagulables, confirman las características propias de esta entidad.
Incidencia de eventos tromboembólicos en COVID-19
En esta patología se han descripto múltiples eventos trombóticos que incluyen el sistema venoso y arterial: trombosis venosa profunda (TVP), embolia pulmonar (EP), infarto de miocardio, isquemia mesentérica, isquemia de miembros inferiores, accidente cerebro vascular.
A pesar de la tromboprofilaxis, la tasa de ETV (trombosis venosa profunda o embolia pulmonar) en pacientes críticos reportada es de 5-10% (18). Bajo profilaxis la incidencia de ETV en pacientes con COVID-19 no en área crítica varía entre 0.9% a 12.5% y en unidad de cuidados intensivos (UCI) está entre el 16-35% (19–25). Por otro lado, se detectó mediante ultrasonido 25% de trombosis asintomática, así como EP en ausencia de TVP (21,23,26). Considerando estos hallazgos, se ha insistido que, ante el súbito deterioro clínico de un paciente, caracterizado por hipoxemia, la sospecha de embolia pulmonar debe ser alta. Así como el empeoramiento de la relación ventilación perfusión, la pérdida del reflejo vasoconstrictor por hipoxia que perpetúan el síndrome de distrés respiratorio agudo (SDRA) deben orientarnos a marcada trombosis pulmonar microvascular.
Con respecto a las complicaciones hemorrágicas, la información es aún más escasa, Helm J, et al, en 150 pacientes con COVID-19 reportan una incidencia de 2.7% (4 pacientes) que presentaron complicaciones hemorrágicas, considerando que estuvieron relacionadas a eventos traumáticos y en un solo caso a ECMO (25). Salvo este reporte, podemos considerar que, en sí, no existe a la fecha datos que permitan relacionar directamente a la infección viral con alteraciones hematológicas que generen hemorragia.
¿Cómo la combatimos?
En el primer reporte de Wuhan, el uso en dosis profiláctica de heparinas de bajo peso molecular (HBPM) o heparina no fraccionada (HNF) se asoció a reducción de la mortalidad a 28 días (40% vs 64.2%; p=0.029) en pacientes con COVID-19 severa y en quienes presentan niveles de dímero D elevados por más de 6 veces del límite superior de la normalidad (32.8% vs 52.4%, p=0.017) (27). En un estudio observacional de más de 2500 pacientes de un único centro en Nueva York, el uso de heparinas en dosis de anticoagulación se asoció con menor mortalidad en pacientes que se encontraban en ventilación mecánica, sin que exista diferencia entre aquellos pacientes que sólo recibían profilaxis; cabe mencionar que este trabajo ha sido criticado por no considerar el sesgo de inmortalidad.(28)
Potencialmente las heparinas pueden mejorar la prevención de ETV, si no también intervenir en la microtrombosis. A estos resultados, si sumamos las propiedades no solo anticoagulantes si no antinflamatorias de las heparinas, (29), más aún si le sumamos efectos antivirales (30) y la baja tasa de eventos hemorrágicos, se han posicionado como la nueva panacea del tratamiento.
Al momento la evidencia que demuestre eficacia y seguridad es escasa como para recomendar la anticoagulación con heparinas como tratamiento estandarizado para todos los pacientes con COVID-19 severa, más allá de indicaciones establecidas de anticoagulación, línea que han mantenido las sociedades internacionales (31,32). Tampoco se ha estandarizado la llamada profilaxis intensiva en determinadas circunstancias; el manejo no está consensuado, por lo que cada institución ha planteado su protocolo interno para estos casos (33,34). Lo que se ha consensuado es la necesidad de evaluar adecuadamente la probabilidad pre-test de presentar, tener alta sospecha clínica de complicaciones según evolución y utilizar herramientas como el ultrasonido para descartar eventos. (Tabla Nº 2)
Muchas dudas nos quedan por resolver, más allá del tiempo y dosis adecuada de heparinas, así como la necesidad o no de combinar antiagregantes plaquetarios y en qué momento los fibrinolíticos tendrían lugar como parte del tratamiento de COVID-19 en su forma severa o no. Dadas las experiencias con otros grupos farmacológicos, en los que la intuición y lógica apoyadas en el razonamiento fisiopatológico, fallaron al ser sometidos a ensayos clínicos, la prudencia terapéutica más no la inercia puede ser la única respuesta certera que tenemos a la fecha.
BIBLIOGRAFÍA
1.Siddiqi HK, Mehra MR. COVID-19 illness in native and immunosuppressed states: A clinical–therapeutic staging proposal. J Hear Lung Transplant [Internet]. 2020;39(5):405–7. Available from: https://doi.org/10.1016/j.healun.2020.03.012
2.Guan W, Ni Z, Hu Y, Liang W, Ou C, He J, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382(18):1708–20.
3.Levi M, Thachil J, Iba T, Levy JH. Coagulation abnormalities and thrombosis in patients with COVID-19. Lancet Haematol. 2020;7(6):e438–40.
4.Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet [Internet]. 2020;395(10229):1054–62. Available from: http://dx.doi.org/10.1016/S0140-6736(20)30566-3
5.Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, et al. Risk Factors Associated with Acute Respiratory Distress Syndrome and Death in Patients with Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med. 2020;180(7):934–43.
6.Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18:844–7.
7.Iba T, Levy JH. Inflammation and thrombosis : roles of neutrophils , platelets and endothelial cells and their interactions in thrombus formation during sepsis. J Thromb Haemost. 2018;16:231–41.
8.Iba T, Levy JH, Levi M, Thachil J. Coagulopathy in COVID-19. J Thromb Haemost. 2020;0–2.
9.Risitano AM, Mastellos DC, Huber-lang M, Yancopoulou D, Garlanda C, Ciceri F, et al. Complement as a target in COVID-19 ? Nat Rev Immunol [Internet]. :19–20. Available from: http://dx.doi.org/10.1038/s41577-020-0320-7
10.McFadyen JD, Stevens H, Peter K. The Emerging Threat of (Micro)Thrombosis in COVID-19 and Its Therapeutic Implications. Circ Res. 2020;
11.Fletcher-sandersjöö A, Bellander B. Is COVID-19 associated thrombosis caused by overactivation of the complement cascade ? A literature review. Thromb Res [Internet]. 2020;194:36–41. Available from: https://doi.org/10.1016/j.thromres.2020.06.027
12.Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497–506.
13.Bazzan M, Montaruli B, Sciascia S, Cosseddu D, Norbiato C, Roccatello D. Low ADAMTS 13 plasma levels are predictors of mortality in COVID ‑ 19 patients. Intern Emerg Med [Internet]. 2020;4–6. Available from: https://doi.org/10.1007/s11739-020-02394-0
14.Wright FL, Vogler TO, Moore EE, Moore HB, Wohlauer M V, Urban S, et al. Fibrinolysis Shutdown Correlation with Thromboembolic Events in Severe COVID-19 Infection. J Am Coll Surg [Internet]. 2020;231(2):193-203.e1. Available from: https://doi.org/10.1016/j.jamcollsurg.2020.05.007
15.Iba T, Levy JH, Levi M, Connors JM, Thachil J. Coagulopathy of Coronavirus Disease 2019. Crit Care Med. 2020;Publish Ahead of Print:1–7.
16.Connors J, States U, Levy J, States U. COVID-19 and its implications for thrombosis and anticoagulation COVID-19 and its implications for thrombosis and anticoagulation Affiliations : 1 ) Department of Medicine , Hematology Division , Brigham and Women ’ s Hospital , Harvard Correspondence : J. Blood. 2020;2(3):1–21.
17.Fogarty H, Townsend L, Cheallaigh CN, Bergin C, Martin-loeches I, Browne P, et al. COVID19 coagulopathy in Caucasian patients. 2020;(May):1044–9.
18.Cook DJ, Crowther MA. Thromboprophylaxis in the intensive care unit: Focus on medical–surgical patients. Crit Care Med. 2010;38(2 Suppl.):S76–82.
19.Zhang L, Feng X, Zhang D, Jiang C, Xie M. Deep Vein Thrombosis in Hospitalized Patients With COVID-19 in Wuhan, China Prevalence, Risk Factors, and Outcome Downloaded. Circulation. 2020;142:114–28.
20.Lodigiani C, Iapichino G, Carenzo L, Cecconi M, Ferrazzi P, Sebastian T, et al. Venous and arterial thromboembolic complications in COVID-19 patients admitted to an academic hospital in Milan , Italy. Thromb Res [Internet]. 2020;191(April):9–14. Available from: https://doi.org/10.1016/j.thromres.2020.04.024
21.Klok FA, Kruip MJHA, Meer NJM Van Der, Arbous MS, Gommers DAMPJ, Kant KM, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res [Internet]. 2020;191(April):145–7. Available from: https://doi.org/10.1016/j.thromres.2020.04.013
22.Thomas W, Varley J, Johnston A, Symington E, Robinson M, Sheares K, et al. Thrombotic complications of patients admitted to intensive care with COVID-19 at a teaching hospital in the United Kingdom. Thromb Res [Internet]. 2020;191(April):76–7. Available from: https://doi.org/10.1016/j.thromres.2020.04.028
23.Poissy J, Goutay J, Caplan M, Parmentier E, Duburcq T, Lassalle F, et al. Pulmonary Embolism in Patients With COVID-19. Circulation. 2020;142:184–6.
24.Llitjos J-F, Leclerc M, Chochois C, Monsallier J-M, Ramakers M, Auvray M, et al. High incidence of venous thromboembolic events in anticoagulated severe COVID-19 patients. J Thromb Haemost. 2020;18:1743–6.
25.Helms J, Tacquard C, Severac F, Lorant IL, Ohana M, Delabranche X, et al. High risk of thrombosis in patients with severe SARS ‑ CoV ‑ 2 infection : a multicenter prospective cohort study. Intensive Care Med [Internet]. 2020;46(6):1089–98. Available from: https://doi.org/10.1007/s00134-020-06062-x
26.Hanify JM, Dupree LH, Jhonson DW, Ferreira JA. Failure of Chemical Thromboprophylaxis in Critically Ill Medical and Surgical Patients with Sepsis. J Crit Care [Internet]. 2017;37:206–2010. Available from: http://dx.doi.org/10.1016/j.jcrc.2016.10.002
27.Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020;1(212):2019–21.
28.Paranjpe I, Fuster V, Lala A, Russak AJ, Glicksberg BS, Levin MA, et al. Treatment Dose Anticoagulation With In-Hospital Survival Among Hospitalized. J Am Coll Cardiol [Internet]. 2020;76(1):122–4. Available from: https://doi.org/10.1016/j.jacc.2020.05.001
29.Thachil J. The versatile heparin in COVID-19. J Thromb Haemost. 2020;18:1020–2.
30.Lang J, Yang N, Deng J, Liu K, Yang P, Zhang G, et al. Inhibition of SARS Pseudovirus Cell Entry by Lactoferrin Binding to Heparan Sulfate Proteoglycans. PLoS One. 2011;6(8):e23710.
31.Thachil J, Juffermans N, Ranucci M, Connors J, Warkentin T, Ortel T, et al. ISTH DIC Subcommittee Communication on Anticoagulation in COVID‐19. J Thromb Haemost. 2020;0–2.
32.Thachil J, Tang N, Gando S, Levi M, Clark C, Iba T, et al. ISTH interim guidance on recognition and management of coagulopathy in COVID-19. J Thromb Haemost. 2020;18:1023–6.
33.Do KPC, Spyropoulos AC, Mahé G, Tafur AJ. Emergence of institutional antithrombotic protocols for coronavirus 2019. Res Pract Thromb Haemost. 2020;4(4):510–7.
34.Mucha SR, Dugar S, McCrae K, Joseph DE, Bartholomew J, Sacha G, et al. Coagulopathy in COVID-19: Posted april 24, 2020. Cleve Clin J Med. 2020;87(5):1–6.
7 comments









































7 Comments
Enrique Sánchez
agosto 11, 2020, 10:36 amExcelente revisión !!
REPLYEnrique Sánchez
agosto 11, 2020, 10:36 amExcelente revisión !!
REPLYGerman Artunduaga
agosto 11, 2020, 3:28 pmMuy buena revisión
REPLYGracias 😊
Hisyovi Cárdenas Suri
agosto 12, 2020, 10:12 amBuena revisión , me gustaría opinar que existe una entidad que explica la respuesta inflamatoria sistémica y la coagulopatia predominantemente microtrombotica con todos los cambios que se describen en el artículo, estaríamos hablando del síndrome catastrófico antifosfolipidico
REPLYPaola Morejón@Hisyovi Cárdenas Suri
agosto 12, 2020, 11:38 amEs muy difícil etiquetar esta enfermedad, tiene características de varias patologías, entre la que menciona hay que incluir púrpura trombocitopénica trombótica, síndrome urémico hemolítico, otras características de anemia hemolítica microangiopática.
REPLYLa única característica propia, es la coagulopatía.
Hisyovi Cárdenas Suri@Paola Morejón
agosto 26, 2020, 9:50 pmPero la única que cumple los criterios o más se acerca de manera global es SAFC ya q se se acompaña de una respuesta inflamatoria exagerada, las demás rara vez dan falla organica, ARDS y tienen criterios diagnósticos definidos q no se ajustan a los pacientes criticos con covid
REPLYRoberto Charles Zabala Perez
agosto 23, 2020, 2:44 amInformación de cardiólogia
REPLY