Prevalencia, causas y tratamiento. Documento del tipo de posición de expertos hecho por la Academia Latino Americana para el estudio de los Lípidos (ALALIP) Avalado Sociedad Interamericana de Cardiología (SIAC), Sociedad Sur Americana de Cardiología (SSC), Colegio Panamericano de Endotelio (CPAE) y Sociedad Internacional de Aterosclerosis (IAS). Ponte-Negretti Carlos I, Isea-Pérez Jesús, Lanas Fernando, Medina
Prevalencia, causas y tratamiento.
Documento del tipo de posición de expertos hecho por la Academia Latino Americana para el estudio de los Lípidos (ALALIP)
Avalado Sociedad Interamericana de Cardiología (SIAC), Sociedad Sur Americana de Cardiología (SSC),
Colegio Panamericano de Endotelio (CPAE) y Sociedad Internacional de Aterosclerosis (IAS).
Ponte-Negretti Carlos I, Isea-Pérez Jesús, Lanas Fernando, Medina Josefina, Medina Felix. Gomez-Mancebo José. Morales Enrique. Acevedo Mónica. Pirskorz Daniel. Wyss Fernando, Machado Livia. Lozada Alfredo. Bryce Alfonzo. Lorenzatti Alberto. Carrera Carlos. López-Jaramillo Patricio. Pinto Xavier. En Nombre del Grupo de autores ALALIP
- Introducción:
La dislipidemia aterogénica (DA) es una entidad clínica que frecuentemente es infra diagnosticada y sub tratada. Una reciente revision sistemática de la literatura concluye que las guías de práctica clínica especializadas en lípidos o en prevención cardiovascular, no consideran la importancia de la DA y/o la abordan de forma tangencial, poco profunda, poco convincente y sin darle la importancia que esta anomalía lipídica tiene sobre el riesgo cardiovascular global y en el riesgo residual de los pacientes1.
La DA se caracteriza por un aumento de lipoproteínas ricas en triglicéridos (LPRTG) y de partículas aterogénicas en el plasma. El interés en las LPRTG ha fluctuado en los últimos años desde ser consideradas como una causa importante de enfermedad cardiovascular ateroesclerótica (ECVA) hasta descartarlas como uno de los factores de riesgo cardiovascular (FRCV). Los resultados de recientes investigaciones epidemiológicas y de randomización mendeliana han renovado el interés en el papel que las LPRTG tienen como factor causal de la ECVA, su impacto en el riesgo residual y el efecto de su óptimo control en la reducción de nuevos eventos cardiovasculares (ECV)2.
Latino América (LA) posee características étnicas, socioeconómicas y culturales que lo distinguen de otras regiones del mundo; actualmente está atravesando por una transición epidemiológica y de cambios de estilos de vida con un aumento del consumo de productos ultraprocesados (PUP) y de alta densidad calórica (harinas fritas y bebidas azucaradas, entre otros), vida sedentaria relacionada con proceso de migración poblacional a las ciudades, que derivan en un aumento significativo en la incidencia de obesidad, sobrepeso y enfermedades cardio metabólicas (ECM), superior a los registrados en otras regiones del mundo3, factores que se asocian con una aumentada prevalencia de DA.
Para revisar las evidencias existentes y extraer conclusiones sobre esta situación, se creó el grupo de expertos denominado Academia Latino Americana para el estudio de los LIPidos (ALALIP) con el objetivo de elaborar un documento que precise la prevalencia de esta condición en nuestra región, y para que realice recomendaciones específicas que permitan optimizar el abordaje de la DA en LA, considerando la prevención, el diagnóstico y tratamiento, con el objetivo de contribuir a la elaboración de políticas públicas dirigidas a reducir la morbimortalidad cardiovascular en nuestra región.
- Metodología:
Se utilizó una modificación del método Delphi4 para lograr una metodología de comunicación sistemática y estructurada y poder extraer opiniones y conclusiones con argumentos soportados en evidencias y discusiones consensuadas.
Se seleccionó a un panel de expertos académicos de diferentes países latinoamericanos (Argentina, Chile, Colombia, Ecuador, Guatemala, México, Paraguay, Perú Y Venezuela ) elegidos en base a su experiencia en lipidología, nutrición y ECM. Todo el panel fue organizado en pequeños grupos de trabajo para responder preguntas específicas previamente sugeridas por los coordinadores. Cada grupo respondió sus preguntas y posteriormente los grupos en conjunto discutieron las respuestas y elaboraron el documento final. Se aceptaron como unánimes aquellas recomendaciones que tuvieron un 100% de aceptación; de consenso, aquellas con, al menos, un 80%; y de desacuerdo, aquellas con menos del 80%. Todas las recomendaciones y conclusiones se incluyeron en el documento final.
Para responder cada pregunta se hizo una revisión sistemática de la bibliografía utilizando las palabras claves: dislipidemia aterogénica, triglicéridos, lipoproteinas ricas en triglicéridos, lipoproteína-colesterol de alta densifdad (HDL-C), riesgo cardiovascular, obesidad, síndrome metabólico, enfermedades cardiometabólicas, y Latino América.
La búsqueda se realizó utilizando las bases de datos bibliográficos MEDLINE, ScIELO, LILACS, Revencyt, BIREME, ScIENTI, LIVECS y PERIóDICA. La literatura no indexada, así como publicaciones oficiales o de organismos internacionales, fueron seleccionadas solamente si la metodología usada para su elaboración fue considerada apropiada. Se dió prioridad a las publicaciones que incluían datos epidemiológicos y de investigación clínica en LA y /o que sus conclusiones fuesen aplicables a esta región.
- Definición de la DA:
La DA es clásicamente definida como un grupo de alteraciones fenotípicas lipídicas caracterizadas por:
- Altas concentraciones de lipoproteínas ricas en triglicéridos (LPRTG).
- Valores séricos normales o levemente elevados de C-LDL pero con mayor número de partículas debido a un predominio de LDL pequeñas y densas.
- Colesterol NoHDL elevado (que se calcula mediante la simple resta del valor del colesterol total menos el valor de C-HDL). Este valor corresponde al colesterol de todas las lipoproteínas aterogénicas incluyendo el de las C-LDL, los remanentes de quilomicrones, las lipoproteínas de muy baja densidad (VLDL) y sus remanentes, las lipoproteínas de densidad intermedia (IDL) y la Lipoproteína “a” , o Lp(a).
- Concentraciones disminuidas de C-HDL
Este perfil lipídico alterado favorece la iniciación y desarrollo acelerado de aterosclerosis5, está clínicamente asociado a ECVA y pobremente considerado en las escalas tradicionales de riesgo6-7.
- Epidemiología de la Dislipidemia Aterogénica en Latino America:
Las enfermedades cardiovasculares aterosclerotica son la primera causa de muerte en LA, correspondiendo un 70% de ellas a infarto del miocardio (IM) y/o ICTUS. Los factores de riesgo modificables para estas enfermedades han sido bien definidos por los estudios INTERHEART e INTERSTROKE, en los cuales LA tuvo una importante participación y entre los que se destacan la obesidad abdominal, la hipertensión, la alterada relacion apolipoprotina B/A1, el tabaquismo y factores sico-sociales8-11.
4 ¿Cuál es la prevalencia de la DA en LA? Es diferente a la de otras regiones?
La prevalencia de esta condición se obtuvo de los estudios realizados en muestras representativas de la población general o regional que incluyeron determinaciones de perfil lipídico (Tabla 1 en el apéndice).
Tabla 1 Prevalencia de C-HDL(C-HDL) bajo y de triglicéridos (Tg) elevados en estudios poblacionales en Latino América
|
Estudio (Referencia) País |
Localidad | Año estudio | Tamaño muestra |
TG elevados # (%) |
| Encuesta Nacional (3)
México |
Nacional | 1992-93 | 2.256 | Global 42.3
Hombres 49.7 Mujeres 36.8 |
| ENSANUT 2006 (4)
México |
Nacional | 2006 | 4040 | Global 31,5
Hombres 36.9 Mujeres 26.9 |
| ENS 2009-10 (5)
Chile |
Nacional | 2010-11 | 4.956 | Global 31,2
Hombres 35.6 Mujeres 27.1 |
| EFRICARD II (6)
Santo Domingo |
Nacional | 2010-11 | 4976 | 21.8 % |
| CARMELA (7)
Venezuela, Colombia, Argentina, Perú, México, Ecuador y Chile |
Barquisimeto Bogotá Buenos Aires Lima C. México, Quito Santiago | 2003-5 | 11.502 | ≥200 mg/dL
9.8-32.5 |
| LASO (8)
|
Argentina, Chile, Colombia, C. Rica, R. Dominicana, Perú, P. Rico, Venezuela | 1998- 2007 | 31.009 | Global 26.5
Hombres 29.9 Mujeres 23.3 |
| CESCAS (9)
Argentina, Chile, Uruguay |
Bariloche, Marcos Paz, Temuco, Pando |
2013-4 |
7.524 |
≥ 200 mg/dL
Global 22.1 % Hombres 29.6 Mujeres 15.5 |
|
PREVENCION (10) Perú
|
Arequipa, |
2004-06 | 1878 | Global: : 39.0
Hombres:46,5 Mujeres:32,3 |
| CRONICAS (11)
Perú |
Lima Puno, Tumbes |
2010 |
3619 |
42.8 |
|
MIGRANT (12) Perú |
Ayacucho, Lima | 2007-8 | 988 | ≥200
24 |
| Marcopito LF (13)
Brazil |
Sao Paulo | 2001-2 | 759 | ≥200 mg/dL,
Global 14.4 Hombres 22.7 Mujeres 5.9 |
|
ISA-Capital (14) Brasil
|
Sao Paulo | 2008 | 719 | 33.9 |
|
Palomo I (15) Chile |
Talca | 2005 | 1007 | Global 40.1
Hombres 47.8 Mujeres 36.2 |
| Lindavista (16)
México |
Ciudad de México | 2013 | 2602 | Global:505
Hombres: 64.5 Mujeres: 43.5 |
| Prevalencia ponderada de 8 estudios (17)
Venezuela |
Región Capital, Occidental, Central, Andes y Zulia | 2005-2010 |
4950 ( datos sobre C-HDL) 5059 ( datos sobreTG) |
TG ≥ 150 mg/dL
Global 36.6 |
La encuesta de salud de México, años 1992-1993, incluyó a 2.256 adultos entre 20 y 69 años de edad con muestras de sangre tomadas luego de 9 a 12 horas de ayuno. En esta muestra urbana, seleccionada de 417 ciudades con poblaciones superiores a 2500 habitantes, se reportó una prevalencia de C-HDL inferior a 35 mg/dL en 46.2 % de los hombres y en el 28.7% de las mujeres; no hubo diferencias en la prevalencia entre los diferentes rangos de edad. Un nivel de triglicéridos (TRG) > 150 mg/dL se encontró en el 49.7% de los hombres y en el 30.8% de las mujeres, siendo progreseivamente mayor a medida que se avanza en edad. La combinación de C-HDL bajo y TRG elevados (valores > 200 mg/dL), se observó en el 12.9 % de la muestra total, siendo esta combinación más frecuente en hombres que en mujeres (20.9% vs 7.2%, respectivamente)12. Esta encuesta se repitió en el 2006, incluyendo 4.040 individuos en el mismo rango de edad, encontrándose que la frecuencia de ambas alteraciones combinadas subió significativamente desde 12.9% hasta 18.3% (41.8% de incremento)13.
La Encuesta Nacional de Salud de Chile, años 2010-2011, fue una muestra representativa nacional seleccionada mediante un muestreo aleatorizado de 4.965 personas entre 18 y 74 años de edad. La prevalencia de TG ≥ 150 mg/dl medidos luego de ayuno de 9 horas o más fue 31.2%, siendo más frecuente en hombres que en mujeres (35.6 % vs 27.1%, respectivamente)14. No hay datos sobre C-HDL.
Un estudio nacional sobre FRCV, con muestreo poblacional hecho en República Dominicana EFRICARD II15, que incluyó 4976 adultos entre 18 y 75 años reportó: una prevalencia de C-HDL <40 mg/dl de 30,7% siendo significativamente mayor en hombres que en mujeres (40 Vs 26,4% p<0,0001), y una prevalencia de TRG >150 mg/dl de 21% igualmente siendo mas prevalente en hombres ( 26,3 Vs 18,3 % p<0,004)
En el estudio “Latin American Consortium of Studies in Obesity” (LASO)16 se analizaron los resultados obtenidos de 11 estudios poblacionales independientes de sección cruzada hechos con similares metodologías en 8 países de LA, con una muestra total de 31.009 participantes provenientes de Argentina, Chile, Colombia, Costa Rica, Perú, Puerto Rico, República Dominicana y Venezuela. En este estudio, donde no hubo un laboratorio central para el procesamiento de todas las muestras, se encontró un 53.3% de prevalencia de niveles bajos de C-HDL (<40 mg/dL en hombres y < 50 mg/dL en mujeres) y un 25.5% de prevalencia de TRG elevados (≥ 150 mg/dL).
El estudio CESCAS I17, una cohorte prospectiva realizada en 4 ciudades (2 en Argentina, una en Chile y una en Uruguay) realizado entre 2013 y 2014, que incluyó a 7.524 personas entre los 35 y 74 años, reportó una prevalencia de 34.1% de C-HDL bajo (< 40 mg/dL) y de 26.5% con TRG ≥ 200 mg/dl.
Además de los estudios descritos Hay algunos reportes mas pequeños de diferentes estudios, que han usado muestras randomizadas de población general, hechos en varios países de América Latina: En Perú, los estudios PREVENCION18 realizado en Arequipa; CRONICAS19 realizado en Lima, Puno y Tumbes; MIGRANT20 hecho en Ayacucho y Lima; estudios hechos en Sao Paulo, Brasil21-22; en la ciudad de Talca en Chile23 y en la Ciudad de México24 (Ver resultados en Tabla No. 1). Cuyos resultados coinciden con los estudios referenciados anteriormente.
En Venezuela, un estudio hecho en 3.108 individuos con 20 o más años de edad que habitaban en Maracaibo25 mostró una prevalencia ajustada por edad 24.1% de DA, con una frecuencia de HDL-C bajo en 65%. Otros datos de 4 estudios mas recientes (n=3.857) también hechos en Venezuela sugieren que la prevalencia ponderada de DA en Venezuela es 24,7%26.
Estos datos de estudios aislados soportan la aseveracion que la DA es epecialmente frecuente en LA, sin embargo dadas las diferencias metodologiocas de los estudios revisados creemos necesario la implementación de un estudio epidemiológico global con una metodología uniforme que determine consistentemente la prevalencia de la DA.
Comparando los datos parciales actualmente disponibles de C-HDL y TG de LA con los de otros países o regiones del mundo se observa que es más alta la prevalencia de estas alteraciones en LA.
En Estados Unidos, la Encuesta Nacional de Nutrición y Salud (NHANES 2009-10) 27 mostró una prevalencia de C-HDL bajo del 30.1% (IC 95%: 29.9-33.2%) la cual es inferior a la prevalencia encontrada en LA16. En España, un estudio realizado en Murcia mostró una prevalencia de C-HDL bajo del 27,3% (IC 95% 25.1-29.4)28. Ambos estudios, el americano y el español, usaron como punto de corte (<40 mg/dL en hombres y <50 mg/dL en mujeres). Estos resultados sugieren que en LA la prevalencia reportada de C-HDL bajo es más alta que la reportada en otras partes del mundo, siendo las prevalencias más altas en mujeres que en hombres
Cuando se utiliza un punto de corte de TG ≥150 mg/dL, la prevalencia de TRG elevados en los estudios hechos en LA, con la excepción del estudio LASO16, es, en general, más alta que en el estudio NHANES donde fue de 24.3% (IC95% 21.6-26.9)27 y que en el estudio español28 donde fue de 22.8% (IC 95% 25.1-29.4%). La prevalencia de TRG elevados fue consistentemente más alta en los hombres en LA.
Finalmente, debe mencionarse que un estudio hecho en Venezuela mostró una menor prevalencia de C-HDL disminuido en la población amerindia que en la población blanca y afrodescendiente26.
No hay estudios en América Latina en los que se hayan cuantificado partículas pequeñas y densas de C-LDL.
- B ¿Cuáles podrían ser las causas de la prevalencia de estas anormalidades lipídicas en LA: socioeconómicas y culturales, alimentarias, genéticas o epigenéticas?
- B. i: Socioeconómicas y culturales: LA tiene una serie de características étnicas, económicas y culturales únicas que influyen en la mayor prevalencia de enfermedades cardio metabólicas (ECM) en nuestra región; de hecho, algunos datos indican que hay diferencias en los mecanismos y en el peso específico de los factores de riesgo en nuestra población29. Además, en LA el stress psicosocial debe ser considerado como un factor adicional de riesgo cardiovascular30.
- B. ii – Alimentarias: El consumo en mayor o menor grado de los diversos tipos de alimentos influirá en la prevalencia de las ECM.
- a) Grasas: En el año 2014 el estudio NutriCoDE del grupo Global Burden of Diseases Nutrition and Chronic Diseases Expert Group31 analizó sistemáticamente 266 encuestas nacionales de nutrición en adultos evaluando el consumo de grasas saturadas, ácidos grasos (AG) omega 6, AG omega 3 de pescado, AG omega 3 de plantas, grasas trans y colesterol de la dieta.
En ese estudio se evidenció que en LA hay un consumo importante de colesterol y de grasas trans en la dieta, particularmente en México en donde su consumo puede ser tan alto como 4,5 gr /día. Las grasas saturadas se consumen en forma similar a otras regiones en vías de desarrollo del mundo, pero los ácidos grasos insaturados se consumen en poca cantidad siendo mas notorio el bajo consumo de AG omega 3 provenientes del pescado. Hay países como Argentina, Bolívia, México y Paraguay, donde su consumo es menor de 50 g/día. Fuentes importantes de grasas son las frituras, las harinas fritas y la grasa proveniente del cerdo.
- b) Azúcares y productos ultraprocesados. El consumo de alimentos con alto contenido calórico es causante de obesidad, diabetes, ECVA y está relacionados con DA. Los azúcares refinados, las bebidas gaseosas con azúcar añadida y los productos ultra-procesados (PUP), que son formulaciones listas para comer o beber que contienen mayores cantidades de azúcar, grasas y sodio son extensamente consumidos en LA ya que son prácticos, ubicuos, muy bien publicitados, con alta palatabilidad y adictivos32-33.
El consumo de PUP está asociado con un aumento del índice de masa corporal (IMC) de adultos en todos los niveles de consumo, luego de ajustes por covariables (R2=0.79; p<0.0001); de hecho, la venta per cápita de estos productos en Kg es un predictor independiente de aumento del IMC en el tiempo32.
La Organización Panamericana de la Salud realizó un estudio para estimar las tendencias de consumo de PUP usando información de venta proveniente de la base de datos de Euromonitor Internacional 201434. Este estudio realizó un análisis de series de tiempo usando encuestas nacionales de 12 países, entre 1999 y 2013, para analizar la asociación entre los cambios en las ventas anuales per cápita de PUP (en kilogramos) y los cambios en el promedio del IMC estandarizada en adultos.
Los datos de IMC fueron obtenidos de la Base de Datos Global de la Organización Mundial de la Salud y los datos para el análisis de covariables fueron tomados del Banco Mundial. Este estudio demostró que el mercado Latino Americano es el tercero en el mundo, detrás de Asia y Canadá, aumentando un 50% entre los años 2000 y 2013; sobrepasando al mercado de los EE UU en la venta de bebidas gaseosas azucaradas en el año 201333.
Hay diferencias en el consumo de PUP entre los países de LA: Los cinco países con mayor consumo per cápita de estos productos son en este orden México, Argentina, Chile Bolivia y Paraguay; y, al mismo tiempo, son los 5 países con el más alto IMC33.
Educar a la población y legislar para reducir el consumo de estos productos es una oportunidad no aprovechada para disminuir la obesidad y las ECM en LA.
- C. iii. Genética y Epigenética. Como vimos anteriormente, en los estudios epidemiológicos hechos en LA se evidencia que la anormalidad lipídica más frecuente son los valores bajos de C-HDL. Un estudio reciente ha sugerido que hay un componente genético asociado a la hipo alfa-lipoproteinemia en poblaciones de ascendencia nativa en LA35. Este estudio, que examinó el impacto de los factores genéticos a la frecuencia de DA en poblaciones nativas de LA, confirmó que el C-HDL bajo es la anormalidad de lípidos más común en las poblaciones de ascendencia nativa americana, reportando prevalencias entre 40 y 50%. La contribución de este rasgo para el síndrome metabólico es mayor en personas con ancestros amerindios que en otros grupos étnicos.
La variante R230C del “ATP-binding cassette transporter” (ABC-A1), cuya presencia está asociada con valores bajos de C-HDL (-4,2%), es común entre los mestizos con ascendencia nativa (10.9% en mestizos mexicanos). Esta variante R230C parece ser específica de las poblaciones amerindias, donde la frecuencia del alelo es 0.28 en Mayas, de 0.214 en Purepechas, de 0.203 en Yaquis y de 0.179 entre los Teenek; en cambio, el alelo R230C no se ha encontrado en poblaciones africanas, europeas, chinas o de asiáticas del sur.
El código genético no es fijo e invariable, hoy en día es absolutamente aceptado que cambios ambientales pueden inducir alteraciones del tipo metilaciones o acetilaciones y cambios en las histonas que alteran la expresión en el código genético y modifican el fenotipo; estos cambios son llamados epigenéticos.
Las modificaciones epigenéticas que sufre la cromatina se asocian al nivel de activación de algunas funciones celulares y pueden ser trasmitidos de una generación de células a la siguiente. Las modificaciones epigenéticas podrían general cambios en la transcripción de la información genética (Transcriptomicos), cambios en la calidad y cantidad de proteínas (Proteinómicos), y en las vías metabólicas reguladas por esas enzimas (Metabolómicas)36.
Los períodos fetales y neonatales son críticos para el desarrollo y crecimiento. El aumento de las tasas de ECM como la DA, observada hoy en día en LA podría ser el resultado de cambios epigenéticos debidos a la discrepancia entre el entorno nutricional durante la vida fetal y temprana, los llamados primeros mil días, y el entorno adulto; esta discrepancia produce un desajuste entre la programación fetal del individuo y los cambios creados por la imposición de nuevos estilos de vida, afectando la expresión y el impacto de los factores de riesgo en las poblaciones37.
Un importante y reciente estudio sobre factores de riesgo cardiovascular para un primer IM9 demostró que en LA, a diferencia de otras regiones, el factor con mayor riesgo poblacional atribuíble fue la obesidad abdominal la cual podría ser debida a los cambios epigenéticos inducidos por las modificaciones del entorno nutricional a través de la vida.
Iberoamérica presenta una mayor susceptibilidad a la aparición de resistencia a la insulina e inflamacion de bajo grado a menores niveles de obesidad abdominal, lo que podría estar relacionado con una respuesta adaptativa del feto a una nutricion fetal deficiente, que resulta en una pérdida de unidades estructurales como nefronas, cardiomiocitos y células beta pancreáticas; estas adaptaciones resultan perjudiciales si en la vida extrauterina la alimentación se vuelve abundante29. En LA, por la alta frecuencia de desnutrición materno-fetal, estas adaptaciones pueden contribuir a un mayor riesgo de enfermedades cardiometabólicas.
- Fisiopatología de la DA y su relación con la ECVA
- 1. Qué Mecanismos originan la DA?: El principal mecanismo implicado en la génesis de la DA parece ser la insulino resistencia. Los TRG y los ésteres de colesterol son los dos lípidos más importantes en la circulación. Por ser hidrofóbicos, es imprescindible que se combinen con proteínas denominadas apoproteinas para formar lipoproteínas y poder así ser transportados en el plasma. El colesterol es transportado por todas las lipoproteínas y está particularmente concentrado en las partículas de C-HDL y C-LDL.
En general, los TRG se transportan en las VLDL, los quilomicrones y sus respectivos remanentes. Por su alto contenido de TRG estas partículas son llamadas LPRTG. Las lipoproteínas además de por el contenido de TRG o colesterol, y su tamaño y densidad, pueden también caracterizarse por las apoproteínas. Así, la apoB100 se encuentra en las VLDL, IDL y LDL; en general esta fracción en conjunto es conocida como colestrol no HDL (C-NoHDL). Las HDL, por el contrario, contienen apoA1 como apoproteina. Los pacientes con DA se identifican fenotípicamente por un exceso de TRG en sangre; y la hipertrigliceridemia frecuentemente se relaciona en forma independiente con trastornos metabólicos como la diabetes mellitus tipo 2, la obesidad y el síndrome metabólico38-39.
En condiciones normales la lipólisis de los TRG en los adipocitos es suprimida por la insulina, (Figura 1) pero en los estados de insulino resistencia, asociados con la obesidad abdominal y el sobrepeso, este fenómeno no ocurre ( y el resultado es la producción aumentada de ácidos grasos libres (AGL) en la circulación portal. Estos AGL llegan al hígado sirviendo de materia prima para la síntesis aumentada de TRG por el hepatocito siendo su consecuencia inmediata (paso 2 de Fig 1) una sobreproducción de partículas de VLDL grandes y ricas en TRG, portadoras de APOCIII, que tienen un mayor tiempo de permanencia en plasma. La lipólisis de este exceso de TRG de las VLDL genera remanentes de VLDL, IDL y finalmente (paso 3, Fig 1) de LDL pequeñas y densas40-41.
Paralelamente los altos contenidos de TG de las VLDL generan un intercambio exagerado de éstos por colesterol entre las VLDL y las HDL debido a la acción de la enzima transferidora de ésteres de colesterol (PTEC) (paso 4, Fig 1), dando por resultado partículas de C-HDL anormalmente cargadas de TRG, las cuales, a su vez, son blanco de la lipoprotein lipasa sensible a hormona (LPL) y de la lipasa hepática, enzimas que las depletan de TRG (paso 5, Fig 1), produciéndose partículas de C- HDL pequeñas y densas que son menos eficientes en el trasporte reverso de colesterol y, además, son eliminadas más rápidamente de la circulación reduciendo en consecuencia su concentración en sangre42. En los pacientes con obesidad visceral las concentraciones bajas de C-HDL plasmático y de apoA1 se relacionan con bajas concentraciones de adiponectina43.
- 2. ¿El exceso de triglicéridos debe ser considerado como el padre de la DA? En los estados de insulinorresistencia, y debido a su mayor tamaño y alto contenido de TRG, la vida media de las LPRTG está prolongada y, en consecuencia, en los períodos posprandiales, los TRG en sangre se mantienen elevados por mayor tiempo del que ocurre en las personas que no tienen resistencia a la insulina. Este fenómeno es conocido como hiperlipemia post prandial44.
Cuando existe un exceso de TRG en plasma, el colesterol viaja en la sangre en mayor proporción en las LPRTG; por lo que la hipertrigliceridemia debe tomarse como un marcador de alteraciones metabólicas asociadas a un aumento de partículas aterogénicas circulantes como las LDLpd44 (Ver Tabla 1).
Los pacientes con LPRTG moderadamente elevadas se identifican por valores de TRG superiores a 200 mg/dl, a partir de esas concentraciones las VLDL circulantes son partículas parcialmente catabolizadas que se denominan remanentes de VLDL que, como dijimos anteriormente, tienen un mayor contenido de ésteres de colesterol. De hecho, a concentraciones de TRG > 200 mg/dl, o cuando la razón TRG/C-HDL es superior a 3,8, más del 40% del colesterol circulante se encuentra en las LPRTG. También, en estos pacientes la vida media de los quilomicrones y remantes de TRG es mayor a 12-24 horas39.
Las VLDL y sus remanentes son tan, o más, aterogénicas que el propio C-LDL y aunque su tamaño es relativamente mayor que el del C-LDL, su capacidad de penetrar al espacio subendotelial y de ser fagocitadas por los macrófagos es similar, con la diferencia que no necesitan oxidarse.
En estos pacientes la medición de C-LDL subestima la carga total de partículas aterogénicas, por lo que en pacientes con un alto nivel de TRG la medición del C-NoHDL nos da una mejor estimación del riesgo cardiovascular ya que incluye el colesterol presente en las partículas de C-LDL y en las LPRTG.
- 3. ¿Cuál es el papel de la resistencia a la insulina? ¿Qué es primero? Las alteraciones antes mencionadas en el metabolismo y la cinética lipídica coexisten porque tienen bases metabólicas comunes y son frecuentemente encontradas en los pacientes con resistencia a la insulina y diabetes mellitus tipo 2. La resistencia a la insulina parece ser el eslabón metabólico que explica las anormalidades que llevan a la DA como lo sugiere la fuerte correlación entre la respuesta en la secreción de insulina en una prueba de tolerancia oral a la glucosa y los niveles de TG en plasma, es decir a mayor resistencia a la insulina, mayor hipertrigliceridemia.
- 4. ¿Cómo se relaciona la DA con las condiciones metabólicas asociadas? La resistencia a la insulina lleva a la acumulación de grasa en el hígado en forma de triglicéridos, fenómeno conocido como esteatosis hepática no alcohólica.
La mayor fuente de exceso de lípidos que ingresan al hígado son los ácidos grasos libres o no esterificados, cuya concentración aumenta en estados de insulino resistencia. (Fig 2) Los mecanismos involucrados a grandes rasgos son dos:
- El exceso de lípidos hepáticos aumenta la incorporación de triglicéridos a las partículas de VLDL y su ulterior secreción lo que contribuye al aumento de apoB100 y apoCIII circulantes.
- Se estimula la sobre actividad de la lipasa hepática que degrada las partículas de C-HDL45-46.
El mecanismo por el cual la sobrecarga de lípidos hepáticos estimula la síntesis de los reguladores de lipoproteinas se desconoce; la hipótesis más aceptada plantea que la oxidación de los ácidos grasos conduce a una sobre síntesis de estos reguladores así como de varios factores de coagulación. Bajo condiciones fisiológicas, la insulina estimula la fosforilación de un factor de transcripción llamado en inglés “Forkhead box protein 01” (FOX01) , proteína que pertenece a una familia que juega un papel importante en la regulación de la expresión de genes implicados en el crecimiento de la célula y en la gluconeogénesis47. En los estados de insulinoresistencia no se inactiva esta vía y aumenta la gluconeogénesis y la lipogénesis de novo48.
La hiperinsulinemia crónica también induce la lipogénesis de novo por estimulación del elemento regulatorio de esterol unido a proteina 1-c y retrasa la degradación intrahepática de la apoB10049 y disminuye la expresión de los receptores de LDL y, en consecuencia, el aclaramiento del LDL.
- 5. Cúal es el papel de la APOCIII? ApoCIII es una apolipoproteína pequeña, sintetizada principalmente en el hígado, que circula en el plasma asociada a las LPRTG. Se ha asociado esta molécula con un mayor riesgo cardiovascular quizás mediante la inhibición de la unión de la apoB100 a su receptor hepático lo que reduce el aclaramiento de las VLDL por el hígado. Otro mecanismo implicado en el papel aterogénico de la apoCIII podría ser la capacidad de inhibir la lipoprotein lipasa endotelial50.
Existen evidencias epidemiológicas que sugieren la relación entre la apoCIII y la DA:
1) En estudios de casos y controles con puntos finales clínicos o angiográficos y en estudios observacionales prospectivos, las concentraciones plasmáticas de lipoproteínas con apoCIII son fuertes factores de riesgo independientes para enfermedad cardiovascular (ECV).
2). Los seres humanos con deficiencia genética de apoCIII tienen bajos valores tanto de LPRTG como de la incidencia de DA50.
- 6. ¿La dislipidemia aterogénica es causa de enfermedad cardiovascular? Evidencias epidemiológicas.
La elevación plasmática del C-LDL es uno de los factores de riesgo más importantes para el desarrollo de la enfermedad arterial coronaria (EAC) y, en menor grado, de la enfermedad cerebrovascular (ECV). Los estudios de intervención con drogas hipolipemiantes, especialmente con estatinas, han mostrado que las reducciones de C-LDL producen reducciones significativas de la morbimortalidad cardiovascular; sin embargo, a pesar de estos beneficios, persiste un nivel de riesgo residual en estos pacientes51. El riesgo residual se debe a múltiples causas: coexistencia de otros factores de riesgo, el riesgo basal individual, factores familiares y genéticos y la presencia de DA.
Existe una gran cantidad de datos epidemiológicos, que demuestran que los niveles de TRG, en ayunas o no, son importantes predictores de eventos cardiovasculares (tabla 2 del apéndice), incluso en individuos que ya han alcanzado niveles recomendados de C-LDL, siendo las evidencias mas robustas de los TRG en no ayunas que los valores en ayunas.
En el Estudio de Salud de las Mujeres52 (n = 26,509) la asociación entre niveles de TRG en ayunas y el riesgo de eventos cardiovasculares no fue significativa (P = 0.90), mientras que cuando se evaluaron los datos de los pacientes con muestras tomadas no en ayunas los resultados si fueron significativos y no se modificaron al hacer el análisis de covarianza (P = 0.006) para colesterol total, C-HDL e indicadores de resistencia a la insulina.
De manera similar, en el Estudio del Corazón de la Ciudad de Copenhagen53 se encontró que la incidencia acumulada de eventos cardiovasculares (ictus isquémico, IM, cardiopatía isquémica) y la mortalidad total, estuvieron relacionados proporcionalmente con el aumento de los niveles de TRG no en ayunas (P= 0.001). Cabe decir que estas asociaciones no se ajustaron para otros parámetros lipídicos.
En pacientes con cardiopatía isquémica tratados con estatinas también se ha demostrado esta asociación: En el estudio PROVE IT, TIMI 22, quedó demostrado que, en los pacientes que recibían estatinas después de un síndrome coronario agudo y alcanzaron niveles óptimos de C-LDL, un valor de TRG en ayunas > 200 mg/dL se asoció a a un mayor número de eventos, incluso después del ajuste para los niveles de HDL-C y LDL-C (cociente de riesgo 0.8; P = 0,025)54. Otros estudios no han encontrado esta asociación positiva entre valores de TRG y eventos CV55.
Basado en lo que hemos revisado, posiblemente sea más correcto utilizar los valores de LPRTG como marcador de riesgo y no exclusivamente el valor de TRG.
Este hecho se evidencia muy bien en un estudio de randomización mendeliana56, un enfoque que minimiza problemas de causalidad inversa y evita factores de confusión, llevado a cabo en 73.513 individuos, que formaban parte de la cohorte del estudio general de Copenhagen, de los cuales 11.984 tuvieron un evento isquémico. A todos los individuos incluidos les realizó un estudio genotípico para variantes que afectan a los niveles de colesterol, C-LDL, remanentes de colesterol no en ayunas, y C-HDL con el fin de buscar una asociación causal entre lipoproteínas y cardiopatía isquémica. Los resultados mostraron que un aumento de los remanentes de colesterol no en ayunas de 1 mmol/l (39 mg/dl) se asocia en forma proporcional con un riesgo incrementado 2.8 veces de cardiopatía isquémica, independientemente de valores bajos de C-HDL. Este hecho implica que el contenido elevado de colesterol que se trasporta en las LPRTG está relacionado con cardiopatía isquémica.
Otros estudios57 de similar metodología han encontrado una asociación independiente entre LPRTG y ECVS, mortalidad total e inflamación de bajo grado. Estos datos sugieren que la DA está asociada con ECVA.
- 7. ¿Puede la dislipidemia aterogénica causar enfermedad cardiovascular? Evidencias fisiopatológicas.
La aterogénesis es el resultado de una excesiva acumulación de partículas lipídicas en el plasma y de un proceso de disfunción endotelial que permite un tránsito incrementado de estas partículas desde la luz vascular hacia la íntima arterial, donde procesos de inflamación, oxidación y migración celular dan origen a la placa aterosclerótica y a sus diversas manifestaciones.
Los estudios epidemiológicos previos han mostrado que existe una relación lineal y contínua entre los niveles de colesterol plasmático y la aterosclerosis58 llegando, incluso a afirmarse que los valores elevados de colesterol plasmático son el único, independiente y absolutamente indispensable factor para la génesis de la aterosclerosis. No obstante, el valor total de colesterol plasmático no permite discriminar entre individuos enfermos y sanos de una población, toda vez que las curvas de distribución de esta variable contínua se sobreponen en ambos grupos59; por esta y otras razones derivadas de la investigación básica, se ha establecido que la relación patogenética entre colesterol y aterosclerosis existe pero con todas las subfracciones de colesterol consideradas como aterogénicas que son VLDL y sus remanentes, IDL, C-LDL y la lipoproteína (a). Estas moléculas comparten entre sí el hecho de poseer una molécula de ApoB100 que les facilita su unión a receptores celulares y entregar ésteres de colesterol a los tejidos60.
En condiciones habituales, aproximadamente 90% de las partículas contentivas de ApoB son moléculas de C-LDL61 , lo que representa un fuerte soporte para la relación entre esta subfracción y la morbimortalidad coronaria; pero, en individuos con DA esta proporción cambia y el porcentaje de colesterol transportado por las LDL disminuye a 2 tercios aumentando la cantidad de colesterol transportado por VLDL y sus remanentes, y las IDL.
- 8. ¿Por qué las LDL pequeñas y densas son más aterogénicas?
Los pacientes con resistencia a la insulina y DA tienen un aumento de LPRTG y un mayor tiempo de residencia de estas partículas en el plasma facilitando el intercambio de TRG y ésteres de colesterol entre estas partículas y las de C-LDL por la acción de las proteínas transportadoras de ésteres del colesterol (CETP). Esto genera un cambio en el tipo de partículas de LDL circulante, generando las llamadas C-LDL pequeñas y densas (LDLpd).
Existen diversas razones por las que estas partículas pequeñas y densas podrían ser más aterogénicas que sus contrapartes de mayor tamaño y densidad:
1) Las LDLpd poseen cambios conformacionales que reducen su afinidad al receptor de LDL y aumentan su tiempo de residencia plasmática, incrementando la posibilidad de interacción y penetración de la barrera endotelial.
2) Las LDLpd penetran 1.5-1.9 veces más la barrera endotelial.
3) Las LDLpd tienen una mayor afinidad para la unión a los proteoglicanos de la matriz subendotelial aumentando su tiempo de residencia en la íntima.
4) Las LDLpd muestran una mayor susceptibilidad a la oxidación y a la glicosilación62-66.
Entre 40 y 50% de todos los pacientes con enfermedad coronaria tienen niveles significativos de LDLpd67. Varios estudios seccionales y prospectivos de casos y controles, han mostrado la interrelación entre el tamaño de las partículas de C-LDL y la incidencia de enfermedad coronaria. En el Estudio Cardiovascular de Québec, los hombres con partículas de C-LDL <25.6 nm tenían un incremento de 2.2 veces en la incidencia de eventos coronarios en comparación a sus contrapartidas con partículas >25.6 nm. El valor predictivo de eventos isquémicos coronarios de estas partículas de menor tamaño era independiente de las otras fracciones lipídicas presentes en el plasma de los pacientes68.
Tambien, en el Estudio de Salud Cardiovascular69 el grupo de pacientes que presentaron IM y angina pectoris tenían mayores concentraciones de C-LDL, y un mayor número de estas partículas de menor tamaño en comparación a los participantes sanos.
El Estudio de Intervención en Diabetes y Aterosclerosis (DAIS)70, hecho en pacientes con diabetes mellitus tipo II tratados con drogas liporeductoras, mostró que el tamaño final de las partículas de C-LDL se correlacionaba inversamente con el incremento porcentual de la estenosis coronaria de estos pacientes. El estudio ARIC71 hecho en 11.419 sujetos seguidos durante aproximadamente 11 años, mostró que el cuartil más alto en comparación al más bajo de LDLpd se asociaba a un riesgo aumentado de eventos coronarios (HR:1.51; IC 95%: 1.21-1.85); aún más, en los individuos considerados de riesgo bajo para eventos coronarios según sus niveles de C-LDL, el LDLpd tuvo mayor capacidad predictiva (HR: 1.61; IC 95%: 1.04-2.0).
Recientemente, el estudio prospectivo de cohortes Ludwigshafen72 mostró, en 1643 sujetos referidos para angiografía coronaria, que no recibían drogas liporeductoras y seguidos por 9.9 años, que las partículas de LDL-C de menor tamaño (<16.5 nm) se asociaban a mayor riesgo de mortalidad total (HR: 1.24; IC 95%: 0.95-1.63) y cardiovascular (HR: 1.54; IC 95%: 1.06-2.12) que las partículas de tamaño intermedio (16.5-16.8 nm). Estos resultados fueron robustos incluso luego de ajustarse para edad, sexo y otros factores cardiovasculares de riesgo.
- 9. ¿Podrían las LPRTG generar aterosclerosis?
Como ya se dijo, las LPRTG comprenden una variedad de partículas de lipoproteínas que difieren en tamaño, densidad y contenido lipoproteico, pero que tienen en común una proporción significativa de TRG en su composición. Estas pártículas comprenden los quilomicrones, las VLDL tipo 1 (grandes y menos densas), las VLDL tipo 2 (de menor tamaño) y los remanentes de quilomicrones y VLDL y las IDL.
Para calcular el valor de estas LPRTG, también conocido como Colesterol NoHDL y NoLDL, se restan los valores de C-HDL y C-LDL del valor de colesterol total. Desde el punto de vista fisiopatológico estas partículas podrían tener también un potencial aterogénico por diversas causas73: (Figura 3)
- Debido a su pequeño tamaño, las VLDL tipo 2 pueden emplear el mecanismo de transcitosis, con vesículas cubiertas de la proteína clatrina, para atravesar el endotelio vascular y pasar a la íntima arterial74.
- Por contener aproximadamente cuarenta veces más colesterol que las partículas de C-LDL, al penetrar al espacio subendotelial llevan más colesterol a la íntima arterial75.
- Una vez en el espacio sub endotelial estas partículas pueden ser fagocitadas por los macrófagos sin necesidad de ser oxidadas para formar células espumosas76.
Se han encontrado LPRTG en placas ateroscleróticas humanas y en preparaciones animales sugiriendo su eventual contribución a la formación de la placa y a la progresión de la enfermedad aterosclerótica77-79.
Otro fenómeno implicado en el rol pro aterogénico de las LPRTG es mediado por la enzima lipoprotein lipasa (LpL) expresada en la superficie luminal del endotelio. Esta enzima hidroliza las LPRTG liberando ácidos grasos libres (AGL) que penetran por difusión simple a las células endoteliales donde son parcialmente convertidos en Acil-CoAs hidrofílicos requeridos para múltiples funciones celulares. Sin embargo, si hay una proporción significativa de estos ácidos grasos de tipo saturado (AGS), al penetrar al interior de la célula endotelial podrían tener efectos proapoptóticos y de inhibición directa de la óxido nítrico sintentasa endotelial induciendo toxicidad y disfunción endotelial en forma directa.
Los AGS también están implicados en la activación del factor nuclear Kappa-Beta y en la consecuente inducción de la formación de citoquinas y quimioquinas proaterogénicas, así como de moléculas de adhesión que incrementan el reclutamiento de monocitos a la pared arterial80. Estos efectos no los tienen los AGL mono o poli insaturados, de allí que la ingesta de ácidos grasos insaturados omega 3 puede prevenir o reducir estos fenómenos.
Además de la ApoB100, las LPRTG tienen en su conformación a la apolipoproteína CIII (ApoCIII) la cual desarrolla acciones biológicas múltiples que se han implicado con la aterogénesis81. La ApoCIII, modula la actividad de enzimas implicadas en el metabolismo de las lipoproteinas; así, puede elevar la concentración plasmática de las LPRTG al inhibir su degradación por la LpL endotelial, y puede reducir su captación por el receptor hepático de remanentes de lipoproteínas. Además, la apoCIII puede disminuir acciones “protectoras” de las partícuilas de C-HDL, aumentar la apoptosis de células endoteliales y podría producir algunos efectos anti-inflamatorios directos como ha sido sugerido por algunos restudios experimentales82-84.
Por último, las LPRTG pueden también favorecer la pro-trombosis estimulando la producción de factor tisular desde las células endoteliales y los monocitos85, promoviendo la generación de trombina86, y reduciendo la actividad fibrinolítica87.
5.10. ¿Se favorece la aterosclerosis con los bajos niveles de C-HDL? ¿Qué efectos tienen las LPRTG sobre el C-HDL?
Hay múltiples acciones antiateroscleróticas dependientes de la acción de las partículas de C-HDL, las cuales podríamos resumir como: 1. Realización del transporte reverso de colesterol88, 2.Protección endotelial89, 3. Acción anti-inflamatoria90-92, 4. Acción anti-apoptótica93, 5. Acción anti-oxidativa94, y 6. Acción antitrombótica39,94. Todas estas acciones han contribuído a la elaboración de una hipótesis funcional de protección aterotrombótica que podría explicar un efecto benéfico derivado del incremento del C-HDL. Datos de investigación humana usando infusions de HDL sintético recombinante o de apoA1/complejo fosfolipídico recombinante han mostrado la restauración de la función endotelial en pacientes hipercolesterolémicos y la reducción de las placas ateroscleróticas en pacientes con síndromes coronaries agudos95-96; resultados similares también se han obtenido en otros pacientes con lesiones coronarias o periféricas, aunque se requiere confirmación adicional39.
Por otro lado, bajos niveles de C-HDL se han asociado a un mayor riesgo de eventos cardiovasculares97. En el meta-análisis del Grupo de Colaboración de Factores de Riesgo Emergentes98 hecho en 302.430 participantes provenientes de 68 estudios prospectivos, se demostró que por cada incremento de 15 mg/dL en los valores de C-HDL la relación de riesgo de eventos coronarios (Hazard Ratio), ajustada para factores lipídicos e historiográficos, era de 0.71 (IC 95%: 0.68-0.71).
Bajos niveles de C-HDL están inversamente asociados con las lipoproteínas contentivas de apo-B100 por lo que los primeros se han considerado como simples biomarcadores de las lipoproteínas aterogénicas. Esta circunstancia ha sido resaltada por la falta de asociación entre los niveles de C-HDL y el riesgo de eventos coronarios en el estudio AFCAPS/TexCAPS99, en ensayos terapéuticos con estatinas de alta intensidad100, en la ausencia de reducción de eventos cardiovasculares en ensayos con niacina101-102 y en estudios hechos con inhibidores de PTEC100,103.
Debe mencionarse que el uso de estatinas de alta intensidad podría incrementar la expression de micro RNA-33 y por lo tanto reducir la expression de ABCA-1 con la consecuente reducción del transporte reverso del colesterol lo cual podría, teóricamente, disminuír los efectos benéficos de los tratamientos que incrementan el C-HDL104. Finalmente, estudios de randomización mendeliana también han fallado en demostrar la relación de C-HDL con la producción de eventos cardiovasculares105.
Las lipoproteínas de alta densidad (HDL) son una constelación de partículas que difieren en sus características físicas y propiedades funcionales; así, pueden distinguirse partículas grandes y flotantes (“buoyant”) conocidas como C-HDL2, y partículas pequeñas y densas también llamadas C-HDL3. Las diferencias entre las diferentes partículas están relacionadas a su funcionalidad106 y, aunque ha habido alguna controversia sobre su papel pronóstico, estudios recientes han establecido un efecto protector derivado de las C-HDL3, pero no de las C-HDL2 o C-HDL total107.
Finalmente, debe considerarse que las HDL, particularmente la HDL3 pueden hacerse disfuncionales y ver reducidas sus capacidades antiaterogénicas, bajo ciertas condiciones tales como el incremento del estrés oxidativo y la inflamación108-109.
Altas concentraciones plasmáticas de LPRTG, generan mayor intercambio de TRG de las LPRTG por colesterol de las HDL debido a la acción de la PTEC; este intercambio origina partículas de C-HDL3 más pequeñas y disfuncionantes ricas en TRG que son metabolizadas más rápidamente liberando apoA1 que es eliminada por el riñón. En consequencia, hay una significativa reducción del pool total de apoAI y de C-HDL normofuncionante42.
6) Medidas poblacionales e individuales para prevenir y tratar la DA
6.1. ¿Cómo prevenir el desarrollo de la DA a nivel individual y poblacional?
Las medidas dirigidas a mejorar los hábitos de alimentación y estilo de vida contribuyen a la prevención y a minimizar las complicaciones asociadas a las dislipidemias.
En LA, como se describió en el apartado de epidemiología, los factores que más contribuyen a la incidencia actual de DA son la malnutrición, caracterizada por un elevado consumo de azúcares y carbohidratos refinados que tienen una alta densidad calórica, una inadecuada relación entre el consumo de grasas saturadas y poli-insaturadas, el sedentarismo y la obesidad110-111.
Diversas intervenciones han demostrado su efectividad en mejorar los distintos parámetros de la DA; su impacto aislado a corto plazo en la morbimortalidad cardiovascular asociada es controvertido, pero lo que sí es definitivo es que se requiere un cambio global, integrado y mantenido en el tiempo para obtener una mejoría significativa del riesgo CV (Ver Tabla 4).
Los TRG son el parámetro lipídico que mejor y más rápido responde al mejorar el estilo de vida (cambios de alimentación, ejercicio, pérdida de peso, reducción grasa abdominal), y la magnitud de la respuesta es directamente proporcional a su nivel basal.
Tabla 1
Cambios Terapéuticos del Estilo de Vida que influyen en la DA
| Mantener un peso saludable
· Peso normal = IMC 20 – 25 · Reducción del 5 – 10 % del peso, si el paciente tiene sobrepeso. |
| Ingesta de calorías totales diarias recomendadas (CTDR)
· Ingesta de CTDR ≈ 25 – 30 Kcal x Kg de peso ideal · Distribución = Hidratos de Carbono (HC) < 50 %, Grasas 25 – 35 %, Proteínas 15 – 20 % |
| Reducción del consumo de carbohidratos (CHO)
· < 50 – 60 % de las CTDR · ↓ de azúcares de absorción rápida o de alto índice glucémico |
| Modificación del patrón de consumo de ácidos grasos y colesterol
· ↓ Ácidos grasos saturados < 7 % de las CTDR · ↓ Grasas trans< 1 % de CTDR · ↑ Ácidos grasos monoinsaturados> 20 % de CTDR · ↑ Ácidos grasos poli-insaturados > 10 % de CTDR · ↓ Colesterol < 200 mg / día |
| Consumo de proteínas
· < 15 % de las CTDR |
| Moderar el consumo de alcohol
· Hombres = < 3 bebidas al día y/o < 170 g a la semana · Mujeres = < 2 bebidas al día y/o < 100 g a la semana |
| Controlar el consumo de sal
· Na+ : 3 a 5 g al día (7.5-12.5 g de sal/día) |
| Ejercicio físico
· Caminar (actividad física moderada) > 150 minutos a la semana ó 75 minutos de actividad física más vigorosa a la semana. Deben combinarse con ejercicios de resistencia para prevenir la sarcopenia |
| Otros elementos
· Agua > 8 vasos al día · Fibra soluble > 20 g al día · > 5 raciones al día de alguno de los siguientes: frutas, vegetales, cereales integrales · Control del estrés psico-social |
El consumo de alimentos con un adecuado aporte calórico, que se ajuste al consumo energético diario y que ofrezca un balance de macro y micronutrientes necesarios para un adecuado funcionamiento corporal, son la base para prevenir la aparición de la DA. 111
El consumo de alimentos ricos en carbohidratos simples de fácil y rápida absorción, así como el consumo de grasas saturadas y alimentos procesados, bajos en fibras y nutrientes, representan los principales elementos de la dieta a corregir por su vinculación a la DA 112
Estudios clínicos clásicos, el Lyon Heart study, y más recientemente el estudio PREDIMED113 basados en el consumo de una dieta estilo mediterránea han demostrado un menor riesgo cardiovascular, con beneficios en los parámetros cardiometabólicos, Esta dieta se caracteriza por un alto consumo de aceite de oliva, frutas no procesadas, frutos secos, verduras y cereales integrales, un consumo moderado de pescado y aves de corral y una baja ingesta de productos lácteos, carnes rojas, carnes procesadas y dulces.
Las guías europeas 2016 recomiendan el consumo de una dieta estilo mediterráneo y especifican las siguientes recomendaciones114:
- Los ácidos grasos saturados deberían constituir menos del 10 % de la carga energética total e, idealmente, deberían ser reemplazados por ácidos grasos poli-insaturados.
- Ácidos grasos trans: evitarlos en los alimentos procesados.
- Menos de 5 g de sal de mesa por día.
- 30 a 45 g de fibra por día, derivados de productos de granos enteros, frutas y vegetales.
- 200 g de frutas por día (2-3 porciones).
- 200 g de vegetales por día (2-3 porciones).
- Pescados al menos dos veces por semana, uno de los cuales debe ser graso.
- Consumo de bebidas alcohólicas limitado a dos copas diarias (20 g diarios de alcohol) en el hombre, y una copa por día (10 g diarios de alcohol) en la mujer.
6.1. i Nutrientes específicos:
- a) Grasas. En Junio de 2008 a instancias de la Organización Panamericana de la Salud se produjo un documento denominado Declaración de Río de Janeiro “Las Américas Libres de Grasas Trans”, el cual como parte de un política pública para reducir el riesgo CV, recomienda taxativamente que los AG trans no deberían superar el 2% del total de grasas en aceites y margarinas, y el 5% del total de grasas en alimentos procesados115. Los AG trans no son nutrientes, y su ingesta aumenta los niveles de C-LDL, reduce el C-HDL e incrementa el riesgo de padecer enfermedad coronaria116.
Los AGS incrementan también los niveles plasmáticos de C-LDL, siendo los más deletéreos los ácidos mirístico y palmítico. Los AG poli-insaturados omega 3 y 6 están presentes en distintas proporciones en los aceites de maíz, canola, soja y girasol, y los AG mono-insaturados, que son más abundantes en el aceite de oliva, reducen los niveles plasmáticos de colesterol total, C-LDL y TRG. Igualmente, tienen impacto en las LDLpd y en el C-HDL. En una dieta occidental tradicional se consumen cantidades aceptables de AG omega 6, por el contrario los AG omega 3 requieren ser complementados de fuentes animales, específicamente de pescado117.
El riesgo de enfermedad coronaria se reduce entre un 2% y 3% por cada 1% de reducción en la carga calórica diaria proveniente de los AGS y su sustitución por AG poli-insaturados. La adopción de estas recomendaciones nutricionales puede reducir hasta en un 16% la incidencia de eventos cardiovasculares y en un 9% la mortalidad cardiovascular.
Las principales fuentes dietéticas de AG omega 3 son los pescados de aguas frías y los aceites de pescados, y algunas variedades de granos y oleaginosas, como canola, soja, linaza (lino), aguacate (palta), semillas y frutos secos116-118. (Ver Tabla No. 3).
b) Alcohol. El consumo de alcohol en cantidades y frecuencia mayor a la recomendada por las guias, incrementa de manera significativa los niveles de TRG, inclusive en mayor intensidad que el consumo de carbohidratos simples, por lo cual siempre se debe verificar el nivel de su ingesta en el paciente con DA.
c) Hidratos de carbono y productos ultra procesados. La ingesta elevada de hidratos de carbono presentes en azúcares, endulzantes, harinas y alimentos de alta densidad calórica se almacenan en forma de tejido adiposo funcionalmente inactivo. Las principales fuentes de alimentos de alta densidad calórica en LA son las harinas fritas (pasteles, frituras, empanadas entre otros) y los PUP110, 119-120. Los azúcares simples, grasas saturadas y trans, son los principales componentes de los
Como se detalló en la sección de epidemiología, el consumo de este tipo de productos viene incrementándose exponencialmente en el mercado de LA, donde son se consideran una causa muy importante de incrementos de peso corporal y de morbimortalidad121. Por ser los PUP causa fundamental de riesgo de obesidad y sobrepeso, y consecuentemente de DA, en LA, disminuir su consumo a nivel individual y a nivel poblacional debe ser un objetivo prioritario en la lucha contra la obesidad y las ECM120. Los médicos deben estimular el consumo de alimentos menos procesados y más naturales; además, es también importante estimular el diseño de políticas públicas y educacionales que detengan los efectos nocivos causados por este tipo de alimentos.
En ese sentido, el consumo de frutas enteras o verduras no almidonadas de origen natural, ingeridas diariamente, reducen entre un 4% y 5% el riesgo de padecer enfermedad coronaria o Ictus. Se ha demostrado que quienes ingieren entre 3 a 5 porciones de frutas y verduras reducen un 11% su riesgo de ictus y aquellos sujetos que consumen más de 5 porciones presentan un riesgo 26% menor122.
Los médicos y las sociedades científicas de LA deben promover algunas políticas públicas que favorezcan la reducción del consumo de estos alimentos con nulo valor nutriticional y en consecuencia reducir la obesidad y las enfermedades cardiometabólicas asociadas.
Políticas públicas recomendadas:
- Reducir la disponibilidad y accesibilidad de PUP: Añadirles impuestos y/o restringir su venta en cantinas escolares y en tiendas que no sean de alimentos.(En México por iniciativa de las sociedades científicas se impuso un impuesto a las bebidas azucaradas)
- Educar a la población y cambiar la percepción sobre los PUP: Promover un etiquetado detallado y destacar en los envases y la publicidad su efecto sobre la obesidad, y evitar o restringir la publicidad sobre estos productos.
Estas acciones deben ir acompañadas de programas educativos a médicos especialistas como los pediatras, cardiólogos, médicos internistas y a médicos generales y de familia sobre los efectos de estos productos en la salud.
- 2. ¿Qué dietas específicas deben recomendarse a los pacientes para prevenir o tratar la DA?
El ajuste del aporte calórico al peso ideal del paciente con un menor consumo de carbohidratos simples y AGS, cero consumo de AG trans y mayor consumo de AG poli-insaturados y omega 3, asi como frutas fibra y vegetales, son los parámetros a modificar en el paciente con DA o riesgo CV.
Un meta-análisis de 15 ensayos clínicos controlados observó que el consumo de AG omega 3 derivados exclusivamente del consumo de pescados reducen significativamente el peso, la composición de la grasa corporal y el perímetro de cintura118.
El estudio PREDIMED 113, evaluó los efectos de dos intervenciones nutricionales en la prevención primaria de las enfermedades cardiovasculares en individuos de alto riesgo cardiovascular. Los pacientes fueron randomizados a tres grupos: dieta mediterránea suplementada con aceite de oliva, dieta mediterránea suplementada con frutos secos, y una dieta control en la que se aconsejaba una alimentación baja en grasas. La dieta mediterránea en el estudio PREDIMED redujo en un 28% la mortalidad por todas las causas y un 5% el riesgo de mortalidad cardiovascular.
Los efectos del estudio PREDIMED sobre la morbimortalidad cardiovascular propiciaron ajustes en la dieta DASH clásica para transformarla en la dieta HF-DASH (modificada); permitiendo un mayor consumo de calorías derivadas de alimentos grasos con colesterol (ej: huevos), aumentando la carga energética proveniente de las grasas saturadas del 8% al 14%, y reduciendo la energía proveniente de los hidratos de carbono, fundamentalmente de los azúcares y jugos de frutas, al 12%123 (Ver apéndice). Estas modificaciones mejoraron la adherencia y redujeron significativamente los niveles plasmáticos de TRG124.
- 3. ¿Qué actividad física debo recomendar a los pacientes para prevenir o tratar la DA?
La actividad física regular puede reducir el riesgo y la mortalidad cardiovascular. Los beneficios clínicos de la actividad física regular se relacionan con la mejoría de los valores de presión arterial, efectos favorables sobre el control del peso, sensibilidad a la insulina y control glucémico, perfil lipídico, y cascada de la coagulación. Además existe una relación inversa entre el nivel de actividad física y el riesgo de cardiopatía coronaria, reportándose reducciones hasta del 23% de eventos CV.
Se recomienda desarrollar de 5 a 7 veces por semana ejercicios aeróbicos dinámicos durante al menos 30 minutos (entre 2.5 y 5 horas semanales); idealmente complementado con ejercicios dinámicos de resistencia 2 a 3 días por semana, con una carga semanal de 1 a 1.5 horas. En las personas de edad avanzada o con un cierto grado de discapacidad existen evidencias de que realizar períodos repetitivos diarios de actividad física, de aproximadamente 10 minutos de duración, podrían ser igualmente beneficiosos que realizar sesiones prolongadas, y muchas veces extenuantes125.
La cuantificación de la actividad física suele medirse en Mets/semana. Un MET es una unidad de medida del metabolismo basal y se define como el costo energético de permanecer sentado en reposo, que es aproximadamente 1 kcal/minuto.El gasto energético esperado para un adulto está entre 1200 a 1500 kcal/día, variando en función del sexo, edad, y actividad física, entre otras.
Las actividades más adecuadas para el entrenamiento son aquellas que incluyen el ejercicio de grandes grupos musculares de forma rítmica y continua y con una intensidad y duración moderada (caminar, trotar, nadar, ciclismo). La actividad física a desarrollar debe ser de moderada intensidad, definida como aquella que se realiza entre el 40 y 59% del volumen de oxígeno consumido o de la reserva de frecuencia cardíaca, que corresponde a un gasto absoluto de energía entre 4.8 y 7.1 Mets en individuos jóvenes; 4.0 a 5.9 Mets en sujetos de mediana edad; 3.2 a 4.7 Mets en personas de tercera edad; y 2.0 a 2.9 Mets en pacientes muy ancianos112.
- ¿Cómo diagnosticar la Dislipidemia Aterogénica?
- 1. ¿Debe realizarse el perfil lipídico en ayunas o no? Esta es una pregunta que sigue siendo polémica; algunas publicaciones recientes56,126 afirman que, comparativamente, el perfil lipídico realizado no en ayunas es más útil y más informativo para la predicción del riesgo cardiovascular que el hecho en ayunas; además, Friedewald127 ha afirmado que el endotelio está expuesto preponderantemente a lípidos postprandiales.
La Sociedad Europea de Aterosclerosis y la Federación Europea de Química Clínica y Medicina de Laboratorio126, emitieron recientemente una declaración conjunta de consenso en la cual afirman que el ayuno no es requerido de forma rutinaria para la determinación del perfil lipídico. Esta declaración recomienda que de forma habitual se usen mediciones no en ayunas para el perfil lipídico; se deben reportar los valores anormales y las mediciones hechas en ayunas, pudiendo ser complementarias más no excluyentes. Por todo lo expuesto anteriormente, nosotros en este documento no recomendamos la medición en ayunas.
- 2. ¿Cuál debe ser la meta terapéutica en DA: TG, HDL, Apo B, Colesterol No HDL, o remanentes?. No cabe duda que el C-LDL debe continuar siendo la meta primaria en el manejo del paciente con dislipidemia, debido a que ella es la lipoproteína con mayor cantidad de evidencias que objetivizan su fuerte asociación directa con el riesgo de ECVA, tanto en estudios epidemiológicos observacionales como en estudios randomizados con terapia farmacológica, que han mostrado una reducción efectiva de eventos cardiovasculares al disminuir los niveles de C-LDL51,128-129, Es por esto que, tradicionalmente, guías y consensos de diversas sociedades científicas han considerado útil el usar metas terapéuticas del C-LDL en el manejo y seguimiento de los pacientes portadores de dislipidemia130.
Sin embargo, después que la última Guía Americana Conjunta de Lípidos ACC/AHA 2013 no considerase metas terapéuticas sino únicamente indicación de estatinas según el grado de potencias de éstas y el nivel de riesgo individual, aparece en el mundo académico una controversia sobre si tiene sentido o no considerar las metas terapéuticas131. En relación a este punto, nuestro grupo de trabajo considera unánimemente que las metas terapéuticas son necesarias tanto para el médico como para el paciente ya que permiten precisar la intensidad de tratamiento farmacológico y estimular al paciente a conocer su riesgo y mantener su terapia. Varias guías nacionales en LA comparten esta posición y mantienen la necesidad de emplear metas de C-LDL 132-133.
Es cierto que los estudios randomizados no han tenido en su diseño la titulación de estatinas u otros fármacos para alcanzar un objetivo terapéutico, pero al analizar los resultados no cabe duda que los niveles de C-LDL alcanzados se asocian a un determinado riesgo CV134. Un argumento a favor de nuestra posición puede hallarse en el estudio IMPROVE- IT, en el cual la obtención de valores menores de C-LDL (70 vs 50 mg/dL), con la utilización de estatinas + ezetimibe, se acompañó de una mayor reducción de eventos cardiovasculares independientemente de recibir ambas ramas igual dosis de estatinas135.
En el paciente con DA, una vez alcanzada la meta de C-LDL, se debe considerar como segundo objetivo terapéutico el C-NoHDL; este valor al resumir la suma de lipoproteínas de colesterol ricas en TRG más el C- LDL nos da mayor información sobre el potencial aterogénico del plasma de los pacientes con DA136-137 . Consideramos que en el sujeto con DA, evaluar y tratar sólo el C-LDL subestima el riesgo residual dado por las LPRTG.
La determinación del C-NoHDL es fácil, económico y representa una excelente correlación con los niveles plasmáticos de apoB100138. Recordemos que la apoB100 es el marcador más preciso de riesgo aterogénico lipoproteico puesto que se localiza en todas las partículas potencialmente aterogénicas, incluyendo la subestimada Lp (a) 139-140. Sin embargo, su análisis tiene un alto costo y no se encuentra universalmente disponible; así, aunque en el estudio INTERHEART9 se analizó la relación apoB100/apoA1 y se observó mayor riesgo entre terciles altos, los estudios clásicos con estatinas no han reportado información de niveles de apoB100 ni los objetivos terapéuticos con los mismos. Por lo tanto, y teniendo en cuenta que existe una estrecha corelación entre concentración plasmática de apoB100 y C-NoHDL, lo más razonable es la evaluación de este último.
- ¿Qué fármacos han demostrado efectividad en el tratamiento de la DA y cuál es su efecto en la morbimortalidad CV?
Hemos dicho que la meta primordial de la terapia hipolipemiante debe ser el C-LDL; pero, aquellos pacientes que luego del tratamiento óptimo con CTEV y estatinas persistan con valores elevados de TRG y de C-No HDL, deben recibir tratamiento farmacológico combinado para reducir el riesgo residual asociado con las LPRTG.
Aunque la definición clínica de la severidad de la HTG difiere entre las distintas guías, la mayoría de las directrices la definen como un nivel de TG >500 mg/dL39, 132, 140-142; en este caso la disminución de los TG tiene como objetivo la necesidad de reducir el riesgo de pancreatitis, que es mayor al riesgo de cardiopatía isquémica, cuando los pacientes tienen estos valores. Esta posición es compartida unánimemente en este documento, por lo que las siguientes recomendaciones terapeúticas van dirigidas exclusivamente a pacientes con valores de TG>200 mg/dl y < a 500 mg/dl, es decir en pacientes en los cuales el objetivo sea la reducción del riesgo de ECVA.
Las familias de fármacos que tienen efecto sobre la reducción de los TRG son 3: Fibratos, AG Omega 3 eicosapentaenoico (EPA) y docosahexaenoico (DHA), y la Niacina (Tabla 4). Todas estas familias tienen efectos metabólicos sobre las LPRTG, reducen efectivamente los TRG y el C-NoHDL y elevan el C-HDL, aunque con diferencias en potencia entre cada una de ellas; así, los Omega-3 y los fibratos tienen un menor efecto sobre el C-HDL en gran parte dependiente de la disminución de TRG y del C-HDL basal. Los resultados en ensayos clínicos con estas familias de fármacos han sido variables pero cuando se analiza su uso en pacientes con DA hay coincidencia en su beneficio en la disminución del riesgo CV.
Las estatinas continúan siendo el pilar del tratamiento de la dislipidemia y su riesgo asociado, pero por ser su objetivo la reducción del C-LDL no serán discutidas en este documento.
TABLA 3 – Mecanismo de acción y efectos de las drogas que reducen los niveles de TRG
8.1. Fibratos Los fibratos disminuyen los niveles de TRG en 36%, los niveles de C–NoHDL entre 6 % y 16% y producen un aumento de 10% del C-HDL, y los niveles de LDL-C los disminuye solo en 8%. En pacientes con hipertrigliceridemia (HTG) muy severa se puede observar un leve aumento del C-LDL inducido por los fibratos.
Hasta la fecha, los ensayos clínicos randomizados (ECR) para estudiar los efectos de los fibratos en la morbimortalidad CV han tenido resultados dispares143-146: algunos estudios sugieren un beneficio modesto, particularmente cuando existen otros factores de riesgo además de HTG, como es el caso de pacientes con C-HDL bajo o síndrome metabólico. Por otra parte, hay resultados negativos en otros ECR.
Los meta análisis de ECR han sugerido también beneficios con el uso de fibratos en HTG. El meta.análisis de Jun, hecho con 18 ECR que utilizaron fibratos para demostrar su efecto en el riesgo CV, que incluyó a 45.058 individuos, encontró una reducción significativa de ECVA (RR 10%; P = 0.048), pero sin efecto en la mortalidad total147. Otro meta análisis, con 5.068 pacientes con valores de TRG >200 mg/dl y C-HDL<40 mg/dl mostró una reducción de eventos CV de 29%; posiblemente este perfil de pacientes sea hasta la fecha el que ha obtenido mayor beneficio de reducción de la morbimortalidad CV en los ECR hechos con fibratos148.
Los fibratos son drogas que deben utilizarse con precaución en combinación con estatinas por el riesgo de miopatía severa, rabdomiolisis y daño hepático; por esta razón, aunque no hay una contraindicación absoluta para su uso combinado, excepto para genfibrozilo, los pacientes en los que se utilize esta combinación de fibratos con estatinas deben ser monitoreados para detectar síntomas musculares y cambios en las enzimas musculares y hepáticas.
- 2. Ácidos grasos Omega 3. Las presentaciones de AG omega-3 que son consideradas productos farmacológicos por la Administración de Alimentos y Drogas de los Estados Unidos de Norteamérica (FDA), y que han sido probadas en ensayos clínicos, son formulaciones purificadas de EPA y/o DHA, bien sea en forma de mezcla de ésteres etílicos altamente purificados (<90%) de EPA y DHA o en forma de presentaciones únicas de ácidos carboxílicos de EPA o DHA.
Las presentaciones de libre formulación vendidas como suplementos tienen concentraciones variables de aceite de pescado, no están purificadas, pueden contener otros ácidos grasos, tener concentraciones variables de toxinas y no deben ser utilizadas como fármacos para tratar la HTG.
Los AG omega 3 en dosis entre 2 y 4 gramos al día, han demostrado disminuir los valores de TRG entre 25% y 34%, los niveles de C-VLDL entre 20-42% y aumentar los valores de C-HDL entre 1-3%, y los valores de C-LDL registran un leve aumento entre 5 y 11%149. En general, a mayores valores basales de TRG mayor es el beneficio.
Al igual que como vimos con los fibratos, los ECR con AG omega 3 han arrojado resultados controversiales150-151. Un meta análisis hecho con estos estudios152 incluyó 63.030 pacientes, mostró una reducción significativa de la mortalidad cardiovascular (RR: 0.86; IC 95%: 0.75 – 0.99; P = 0.03), pero no mostró beneficios en la mortalidad total o un punto cardiovascular compuesto de IM, ictus y muerte cardiopvascular (P = 0.24 y P = 0.28, respectivamente). Es importante mencionar que en un análisis de subgrupos de este último meta-análisis, hecho en los pacientes con niveles basales de TRG >150 mg/dl comparados con los que tenían valores <150mg/dl si se demostró beneficio en el punto cardiovascular compuesto. (RR: 0.82; IC 95%: 0.74-0.91; P = 0.006).
El estudio del Gruppo Italiano per lo Studio della Sopravvivenza (GISSI)-Prevenzione153 demostró que en pacientes post-IM, el uso de la combinación EPA y DHA en forma de ésteres etílicos altamente purificados logró reducciones de TRG de 16-20% y redujó significativamente el riesgo de reinfarto y de muerte, luego de un periodo de seguimiento de 3 años.
En el Estudio Japonés de la Intervención en Lípidos (JELIS) en prevención primaria, se utilizaron 1.8 gr de EPA como tratamiento, demostrándose una reducción de 18% de eventos coronarios mayores. El efecto fue más notorio en pacientes con TRG>200 mg/dL y HDL-C< 40 mg/dL, donde la reducción del riesgo fue de 53% en comparación a la monoterapia con estatinas154.
En el estudio Origin154, con un diseño factorial 2×2, se intentó probar el efecto de protección cardiovascular de la insulina Glargina y los AG omega 3 versus placebo en pacientes con diabetes mellitus tipo 2 o con disglicemia. Los AG omega 3 redujeron en promedio un 23% los valores de TRG pero no demostraron efecto en la reducción de eventos CV; este hecho, aparentemente paradójico, podría deberse a que el grupo placebo recibió aceite de oliva que contiene ácidos grasos monoinsaturados con algunas propiedades asociadas con la protección cardiovascular.
La heterogeneidad en los resultados observados en los ECR puede ser debida, en parte, a la inclusión de sujetos con valores basales normales de TRG (< 150 mg/dL), por lo que actualmente se están realizando estudios con AG omega 3 que tienen como requisito obligante la inclusión de pacientes con alto riesgo CV y valores de TRG entre 200 mg/dl y 500 mg/dl156-157.
Los efectos adversos más comunes asociados con AG omega 3 son gastrointestinales (náusea y diarrea), aunque en las presentaciones más purificadas estos efectos son muy escasos. La tasa de interrupción del tratamiento observada en ECR es similar entre AG omega 3 y placebo y, además, no se afecta la función hepática158-159. Es importante destacar que no hay ningún tipo de interacción con estatinas u otras drogas hipolipemiantes por lo que los AG omega 3 se pueden utilizar con seguridad en combinación con las estatinas, con fibratos o en terapia triple.
- 3. Niacina. La niacina reduce los valores de TRG en 20%, los niveles de C-LDL en 12%, de C-NoHDL entre 7% y 39% y aumenta los niveles de HDL-C en 16%. Hasta la fecha los grandes ECR con niacina añadida a estatinas no han demostrado reducciones del riesgo CV101, 160-163. Un análisis post-hoc demostró que en los pacientes con TRG>200 mg/dL y C-HDL < 32 mg/dL, la niacina parece reducir eventos de ECVA en un 37% (P 0.05)164.
Los efectos adversos frecuentes limitan el uso de la niacina: el más común es la vasodilatación cutánea o «flushing» que según algunos reportes puede verse hasta en un 70% de los pacientes164-166. Otros efectos adversos a tener en cuenta son la elevación de la glicemia, efectos gastrointestinales y la miopatía.
Con el fin de minimizar los efectos adversos y aumentar los beneficios clínicos de la niacina se llevó a cabo el estudio HPS-THRIVE en pacientes con aterosclerosis que estuviesen recibiendo estatinas160. Este estudio probó, contra placebo, el uso de una combinación de niacina de liberación extendida y laropiplant, un inhibidor selectivo del receptor de prostaglandina D que es el responsable de los efectos adversos cutáneos de la niacina. HPS-THRIVE no logró demostrar reducción de eventos cardiovasculares en estos pacientes y, al contrario de lo que se esperaba, con la combinación de niacina y laropiplant hubo un exceso significativo de efectos adversos cutáneos, músculo esqueléticos, gastrointestinales y metabólicos. Estos resultados en conjunto con los del estudio AIM–HIGH164 cuestionan la utilización de niacina como terapia de combinación en los pacientes hiperlipidemicos.
- Tratamiento farmacológico de la DA
- 1. ¿Por qué se debe tratar la Dislipidemia Aterogénica? Hasta ahora hemos expuesto y discutido en detalle las evidencias epidemiológicas y fisiopatológicas que demuestran:
1º Que en LA la DA es un factor clave de riesgo CV, con una prevalencia e impacto poblacional mayor a la registrada en otras regiones.
2º Que la DA es causa de ECVA, y de riesgo residual.
3º Que existe evidencia clínica que sugiere que el tratamiento de la DA podría alterar el curso de la aterosclerosis, del riesgo cardiovascular lipídico (tanto en prevención primaria como secundaria) y del riesgo cardiovascular residual.
En ese sentido, este grupo concluye unánimemente que en LA existe la necesidad de llevar a cabo un estudio multicéntrico internacional con el uso de AG omega 3 y/o fibratos en pacientes con DA para demostrar su efecto en la reducción de eventos CV. De la misma forma, se llegó al consenso de cambiar los actuales paradigmas de tratamiento de la DA en LA a fin de que en los pacientes, luego del tratamiento óptimo con estatinas, el colesterol No HDL, como subrogado de las LPRTG, sea tratado para reducir el riesgo cardiovascular residual tanto a nivel individual como global167.
- 2. ¿Con qué se debe tratar la Dislipidemia Aterogénica?
El tratamiento de la DA debería, al menos conceptualmente, modificar las alteraciones metabólicas subyacentes: reducir los TRG, reducir la proporción de partículas LDLpd, elevar el C-HDL, y acelerar el aclaramiento de todas las LPRTG.
Hasta la fecha ninguno de los grandes ensayos clínicos plantea su hipótesis terapéutica específica en los pacientes con DA, así que la información referida al beneficio de estos pacientes es extrapolada del análisis post hoc de subgrupos y de meta analisis. Es importante puntualizar que ningún fármaco es capaz por sí solo de producir todos los cambios lipídicos mencionados por lo que se debe recurrir a combinaciones de drogas; así que, al menos en prevención secundaria y en pacientes con alto riesgo CV y con DA que a pesar del tratamiento óptimo con estatinas persistan con hipertrigliceridemia, se debec indicar tratamiento adicional con AG omega 3 y/o fibratos.
Maki y colaboradores en un reciente meta análisis168 hecho con un grupo de ECR realizados con fibratos, niacina, AG omega 3, solos o combinados con estatinas, demostró que aún cuando no hay reducción global del riesgo cardiovascular en todos los individuos, en el subgrupo con TRG elevados y HDL bajo (elementos constitutivos de la DA) si hubo una reducción estadística importante en el riesgo cardiovascular.
- 3. ¿Qué valor, y de cuál partícula, debe ser escogido para tratar?
Tal y como se comentó anteriormente, la alteración metabólica que mejor define la DA es la hipertrigliceridemia. Por esta razón el valor basal de los TRG debe ser considerado como punto de partida para establecer objetivos y escoger la terapia farmacológica apropiada169-170, luego de la corrección del C-LDL. También, el C-NoHDL, por su mayor capacidad para predecir el riesgo CV debe ser considerado como objetivo terapéutico171.
Como se muestra en la Tabla No. 5, los niveles de TRG se emplean para definir el objetivo terapéutico primario; así, niveles superiores a 500 mg/dL obligan a tener como meta inicial la reducción del riesgo de pancreatitis y secundariamente el riesgo cardiovascular172. Lo contrario ocurre cuando los valores de TRG están entre 200 y 499 mg/dL en donde la reducción del C-LDL es el objetivo primario, siendo el secundario la reducción del C-NoHDL.
El C-HDL bajo se asocia con un aumento del riesgo cardiovascular, pero las intervenciones farmacológicas dirigidas a aumentar este C-HDL no han demostrado consistentemente una reducción del riesgo de eventos clínicos o de la mortalidad. Los cambios terapéuticos del estilo de vida y especialmente el ejercicio, más que los fármacos, son la intervención más eficaz para aumentar al C–HDL130.
Tabla 4
Objetivos terapéuticos basados en nivel basal de Triglicéridos
| TRG (mg/dl) | Clasificación | Objetivo terapéutico | Meta Terapeútica |
| < 200 | Leve | Reducir RCVG | ↓ C-LDL |
| 200 – 499 | Moderada | Reducir RCVG | ↓C-LDL y ↓C- No HDL |
| > 500 | Severa | Reducir riesgo de pancreatitis | ↓ TRG |
*RCVG: Riesgo cardiovascular global
- 4. ¿Cuál es el algoritmo de tratamiento del paciente con DA?. (Figura 4)
Se propone el siguiente esquema para el abordaje general de tratamiento:
- Sugerir de manera clara y precisa los cambios terapéuticos de estilo de vida (CTEV) como paso básico, inicial e insustituible. (Ver Tabla no. 2)
- Evaluar el riesgo cardiovascular global del paciente
- Identificar el objetivo terapéutico (LDL-C y Col-NoHDL) y la meta acorde a su nivel de riesgo (Ver Tabla No. 6). En cada consulta sucesiva debe interrogarse sobre el cumplimiento de estas medidas; sería ideal trabajar con un nutricionista, un psicólogo y un técnico en terapia física. Utilize, de ser posible, aplicaciones electrónicas para ayudar en su cumplimiento.
- Calcular el porcentaje de reducción de C-LDL y Col-NoHDL requerido para alcanzar la meta.
- Las estatinas son la primera opción terapéutica en la mayoría de los pacientes con DA. Escoger la dosis de estatina que, en promedio, pueda lograr la reducción deseada. En consultas sucesivas, de no lograrse la meta de C-LDL, intensificar el tratamiento, utilize ezetimide o escoja alguna de las estatinas más potentes, si es necesario.
- Una vez lograda la meta de C-LDL, verificar si se alcanzó la meta de C-NoLDL y en caso de que no se halla logrado utilize terapia de combinación con AG omega 3 o fibratos.
- 9. 4. i. Principios generales: Tradicionalmente el tratamiento de los lípidos para la reducción de la ECVA se basa en la intervención terapéutica en pacientes con altos riesgos (pacientes con síndrome coronario agudo reciente, cardiopatía isquémica estable, enfermedad vásculocerebral, enfermedad arterial periférica, diabéticos, hipertensos, con hiperlipidemia severa y pacientes con múltiples factores de riesgo no controlados a pesar de recibir tratamiento efectivo). Sin embargo, el mayor número de muertes debido ECVA ocurre en los individuos de riesgo bajo o intermedio, simplemente porque ellos representan un grupo mucho más numeroso173. Por lo tanto el paso inicial indispensable y obligatorio para el abordaje terapeútico de cada paciente debe ser el cálculo del Riesgo Cardiovascular Global para estimar la probabilidad de un evento cardiovascular en los próximos 5 a 10 años; esto tiene varias utilidades: primero, permite clasificar el nivel de riesgo del paciente; segundo, al compartir con el paciente su riesgo lo involucramos en su tratamiento y esto ayuda al cumplimiento del mismo; y, tercero, nos permite definir metas terapeúticas individualizadas174.
Para definir el riesgo global de cada paciente existen diversas fórmulas o tablas de riesgo; sin embargo, no es posible recomendar con certeza absoluta una de estas tablas o fórmulas para LA ya que no han sido validadas en la región.
La escala de Framingham6 es posiblemente la más utilizada; esta escala predice el riesgo de enfermedad coronaria pero existen dudas razonables sobre su aplicabilidad en la población latina ya que puede sub-estimar o sobre-estimar el riesgo175. Otra escala muy utilizada es la de la Sociedad Europea de Cardiología (SCORE: Systematic COronary Risk Evaluation)176 que es el resultado del análisis de 12 encuestas nacionales de países europeos; pero, no está globalmente validada en LA.
Una escala que pudiese ser utilizada con confianza en nuestra región es la derivada del estudio INTERHEART177, que si tiene validación en población latina; el problema es que para su aplicación se necesita medir apoB100 y apoA1, lo cual incrementa su costo y dificulta su aplicabilidad en LA. Por último, el Colegio Americano de Cardiología y la Asociación Americana del Corazón propusieron la ecuación: ACC/AHA – ASCV Risk Estimator Pooled Cohort Equations178 que permite la posibilidad de evaluar el “Riesgo de por vida” (o a largo plazo: 20 – 30 años) lo cual puede ser útil al evaluar pacientes jóvenes (20 – 40 años), con antecedentes familiares de ECVA o factores de riesgo. El problema es que en los registros utilizados para su diseño la representación de población latina era escasa, pero puede ser utilizada conociendo esa limitante.
Hay discrepancias en nuestro grupo sobre cual escala de riesgo, en particular, recomendar; pero, en lo que si hubo consenso es en la imprescindible estimación del riesgo global de cada paciente, y en que la herramienta utilizada sea siempre la misma. Este grupo, además, plantea la necesidad perentoria de diseñar y validar una herramienta regional para este cálculo de riesgo en LA.
Además del cálculo de riesgo, debe realizarse exhaustivamente la búsqueda sistemática de aterosclerosis subclínica que permita diagnosticar la existencia de enfermedad en la etapa preclínica (hipertrofia ventricular izquierda, microalbuminuria, índice tobillo-brazo, calcio coronario, presencia de placas en carótidas o arterias femorales) y de daño a órganos blanco. Finalmente, es importante resaltar que en LA el stress psicosocial es un factor muy importante que debe ser tomado en cuenta para cualquier estimación de riesgo.
Tabla No. 5
Metas terapeúticas según nivel de riesgo132
| Categoría de riesgo | Objetivo col LDL ( mg/dL) | Objetivo col no HDL ( mg/dL) |
| Riesgo alto |
< 70 |
< 100 |
| Riesgo intermedio |
< 100 |
< 130 |
| Riesgo bajo |
< 130 |
< 160 |
4. ii Identificar el objetivo terapéutico y la meta acorde al nivel de riesgo.
Ya hemos hablado sobre la necesidad de establecer los objetivos terapéuticos según los niveles de las fracciones lipídicas. Nuestro grupo mantiene unánimemente la necesidad de establecer y conseguir metas ya que son útiles para orientar la terapia, optimizar e individualizar la reducción de riesgo y monitorizar el cumplimiento de la terapia; en ese sentido sugerimos alcanzar metas según el riesgo (Ver Tabla No. 6).
Como norma, las metas de C-NoHDL son 30 mg/dl mayores que las de C-LDL; de manera que para la mayoría de los pacientes con DA las metas de C-LDL y C-NoHDL serían < 100 y < 130 mg/dl, respectivamente, excepto para los pacientes con enfermedad CV establecida (prevención secundaria) y los diabéticos con riesgo cardiovascular > 7.5 % en 10 años en los cuales las metas serían < 70 y < 100 mg/dl, respectivamente.
- 4. iii. ¿Qué tipo de estatina escoger? Para escoger la estatina y la dosis necesaria para lograr la meta de C-LDL adaptamos las recomendaciones de las Guías para el Tratamiento del Colesterol para Reducir el Riesgo Cardiovascular Aterosclerótico en Adultos131 (Ver Tabla No. 7).
Tabla 7
INTENSIDAD DE TRATAMIENTO CON ESTATINAS131
| ALTA | MODERADA |
BAJA |
|
| Reducción de LDL-C (%) necesaria para llegar a la meta |
> 50 % |
30 – 49 % |
< 30 % |
|
Indicaciones |
ECVA clínica
LDL-C > 190 mg/dl Diabetes, LDL-C: 70-189 mg/dl Riesgo de ECVA > 7.5 %/10 años |
ECVA clínica y edad
LDL-C > 190 mg/dl (Intolerante a estatina de alta intensidad) Diabetes, , LDL-C > 100 mg/dl Sin Diabetes, , LDL-C 70 – 189 mg/d Riesgo de ECVA > 7.5 %/10 año |
Intolerancia a tratamiento con estatinas de intensidad moderada y alta |
| Ejemplos |
Atorvastatina 40 – 80 mg Rosuvastatina 20 – 40 mg |
Atorvastatina 10 – 20 mg Rosuvastatina 5 – 10 mg Simvastatina 20 – 40 mg Pravastatina 40 – 80 mg Lovastatina 40 mg Fluvastatina 80 mg Pitavastatina 2 – 4 mg |
Simvastatina 10 mg Pravastatina 10 – 20 mg Lovastatina 20 mg Fluvastatina 20 – 40 mg Pitavastatina 1 mg |
- 4. iv. Terapia para lograr meta de C-NoHDL.
Además de su consabido efecto sobre el C-LDL, las estatinas reducen los niveles plasmáticos de los TRG en un 15-50% y pueden aumentar el C-HDL hasta un 15%. Estos últimos efectos son proporcionales al nivel basal de los TRG. Así, las estatinas son la primera opción terapéutica para el tratamiento de pacientes con dislipidemia y, luego de lograda la meta de C-LDL, si los niveles de C-NoHDL permanecen elevados se debe escoger una terapia de combinacion para reducirlos. (Ver Tabla No. 8).
Tabla 8
Recomendaciones terapéuticas según el nivel basal de TRG
|
TRG basales (mg/dl) |
Clasificación
Según TRG |
Objetivo
Primario de Tratamiento |
Tratamiento Farmacológico
1a línea u opción |
Tratamiento Farmacológico 2a línea u opción |
|
150 – 199 |
Ligera |
C-LDL |
Estatinas |
Ezetimiba
|
|
200 – 499 |
Moderada |
LDL-COL C- No HDL |
Estatinas |
AG omega 3 Fibratos Niacina |
| > 500 | Severa | TRG para reducir riesgo de pancreatitis | Fibratos
AG omega 3 Niacina |
Estatinas
|
Los pacientes con DA que más se benefician de la terapia combinada son aquellos con TRG> 200 y C-HDL < 40 mg/dl. Los grandes estudios de intervención con estatinas (análisis post hoc de > 4.000 pacientes) apoyan el concepto de un beneficio cardiovascular añadido cuando se combinan estatinas con AG omega 3 o con fibratos en estos pacientes148, 179-181. Los fibratos de última generación como el fenofibrato y el ciprofibrato han demostrado ser más seguros en esta terapia de combinación.
- 4. v: Algoritmo de tratamiento
El algoritmo sugerido diseñado para pacientes con riesgo moderado o alto, y/o con DM refuerza la necesidad de intentar siempre alcanzar la meta de C-LDL como primer objetivo. La meta de C-NoHDL debe ser evaluada luego de al menos 3 meses de óptimo cumplimiento de la terapia y de los CTE y en caso de no haberse alcanzado la meta, una terapia de combinación debe ser usada. (Ver Figura no. 4)
- Conclusiones.
En LA las anormalidades lipídicas relacionadas a la DA tienen una alta prevalencia, probablemente mayor a la observada en otras regiones del mundo. Hemos llegado a esta conclusión luego del análisis sistemático de encuestas nacionales de salud y estudios regionales de cohorte con muestras poblacionales suficientemente grandes como para ser consideradas representativas. Es necesario clarificar que este análisis, aunque está basado en un gran número de reportes y con una población significativa, solo nos permite elaborar una hipótesis que debería motivar un estudio prospectivo de diseño gobal que sea representativo de nuestra entera población (urbana, rural, indígena, afro-descendiente, mestiza, de habitantes de las planicies, de la costa y de las altas montañas) hecho con una única metodología, para estudiar la real prevalencia de la DA y otros factores de riesgo en LA.
Un estudio de este tipo podría ayudarnos a comprender mejor las causas de esta supuesta alta prevalencia de DA en LA y a determinar su impacto económico y humano; adicionalmente, este estudio sería fundamental en el diseño e implementación de políticas públicas y acciones médicas que podrían reducir la prevalencia y consecuencias de la DA en LA.
Nuestra hipótesis es que la causa de esta alta prevalencia de DA en LA parecen ser multiples; postulamos que ellas son el resultado de la interacción, en grados diversos, de la carga genética y sus modificaciones epigenéticas combinadas con un estilo de vida sedentario y una nutrición inadecuada, principalmente derivada de un alto consumo de PUP, grasas trans y colesterol, y de bebidas endulzadas. Todos estos factores están relacionados a las variables psico-culturales y socio-económicas típicas de nuestra región.
Las enfermedades cardiovasculares son la primera causa de mortalidad e incapacidad en nuestro subcontinente, y la DA es causa de ECVA. Las alteraciones lipídicas que definen a la DA incrementan el riesgo de eventos cardiovasculares y cerebrovasculares, y son factores importantes en el riesgo residual de estos pacientes; por lo tanto, la DA debería ser diagnosticada y tratada de una manera efectiva y sistemática.
La meta terapéutica primaria en el tratamiento de la DA es el nivel de C-LDL, definido de acuerdo con el riesgo individual de cada paciente. Después de alcanzar esta meta con la efectiva aplicación de cambios del estilo de vida, el uso óptimo de estatinas y, eventualmente, con la adición de ezetimibe, es necesario alcanzar la meta de C-NoHDL basado en la adición de AG omega 3 y/o fibratos sobre todo en pacientes de riesgo intermedio o alto.
Finalmente, queremos decir que LA es una región con grandes desigualdades económicas y sociales que imponen a su población varias dificultades para el acceso a un diagnóstico y tratamiento adecuados; esta es una de las razones por las cuales en los países latinoamericanos la prevención de las enfermedades cardiovasculares, basada en una mejor comprensión de nuestros factores de riesgo y nuestras características sociales y culturales, debería ser la prioridad número uno, con la ventaja adicional de ser altamente costo-efectiva. En nuestra región la prevención cardiovascular no debería ser una opción sino una obligación.
Como un corolario, es necesario realizar adecuadas investigaciones epidemiológicas que determinen la real prevalencia de DA en nuestra región, sus causas reales y repercusiones médicas, sociales y económicas, para diseñar y aplicar políticas públicas y para tomar acciones médicas que reduzcan su incidencia e impacto.
Lista Completa de Autores Miembros de ALALIP
Argentina
Alberto Lorenzatti
Alfredo Lozada
Daniel Piskorz
Centro América
Fernando Wyss
Chile
Leonardo Cobos
Raúl Villar
Fernando Lanas
Rodrigo Alonso
Paula Varleta
Monica Acevedo
Colombia
Alonzo Merchan Villamizar
Juan Manuel Arteaga D
Patricio López- jaramillo
Ecuador
Ernesto Peñaherrera
Vladimir Ullairi
Joffre Lara
Mexico
Enrique Gómez Alvarez
Enrique Morales
Paraguay
María Paniagua
Perú
Alfonzo Bryce
Felix Medina
Josefina Medina Lozada
Julio Chirinos
Venezuela
Carlos I Ponte N
Carlos Carrera
Jesus E. Isea P.
José R. Gómez Mancebo
Dra. Livia T. Machado
Dr. Juan Colan P
Bibliografía
- Pedro-Botet J, Mantilla-Morató T, Diaz-Rodriguez A, Brea-Hernando A, González-Santos P, Hernández-Mijares A, Pintó X, Millán Núñez-Cortés J. El papel de la dislipemia aterogénica en las guías de práctica clínica: Clin Investig Arterioscler. 2016; 28 (2): 65-70
- Nordestgaard BG. Triglyceride-Rich Lipoproteins and Atherosclerotic Cardiovascular Disease: New Insights from Epidemiology, Genetics, and Biology. Circ 2016 Feb 19; 118 (4): 547-63. doi: 10.1161/CIRCRESAHA.115.306249.
- Ultra-processed food and drink products in Latin America: Trends, impact on obesity, policy implications. Washington, DC: PAHO, 2015. ISBN 978-92-75-11864-1- 9789275118641_en.
- De Villiers M, De Villiers P, Athol K. The Delphi technique in health sciences education research. Med Teach 2005:27(7):639-643.
- Austin MA, King MC, Vranizan KM, Krauss RM. Atherogenic lipoprotein phenotype: a proposed genetic marker for coronary heart disease risk. Circulation. 1990; 82 (2):495–506.
- D’Agostino RB Sr; Vasan RS; Pencina MJ; Wolf PA; Cobain M; Massaro JM; Kannel WB (Feb 2008). «General cardiovascular risk profile for use in primary care: the Framingham Heart Study». Circulation. 117 (6): 743–53.
- Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project European Heart Journal 2003; 24:987-1003.
- Lanas F, Avezum A, Bautista LE, Diaz R, Luna M, Islam S, Yusuf S; INTERHEART Investigators in Latin America. Risk factors for acute myocardial infarction in Latin America: the INTERHEART Latin American study. Circulation. 2007;115:1067–1074Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 652 countries (The INTERHEART study): case control study. Lancet 2004; 364:937-952.
- O´Donnell MJ, Xavier D, Lishung I, Zhang H, Chin SL et al. Risk factors for ischemic and hemorrhagic stroke in 22 countries: results of the first phase of INTERSTROKE in 6000 individuals. Lancet 2010; 376: 112-123.
- O´Donnell MJ, Chin SL, Rangarajan S, Xavier D, Liu L et al. Global regional effects of potentially modifiable risk factors associated with acute stroke in 32 countries (INTERSTROKE): a case control study. Lancet 2016. 15 pii: S0140-6736-2 (E pub ahead of print).
- Aguilar-Salinas CA, Olaiz G, Valles V, Torres JM, Gómez Pérez FJ, Rull JA, Rojas R, Franco A, Sepulveda J. High prevalence of low HDL cholesterol concentrations and mixed hyperlipidemia in a Mexican nation-wide survey. J Lipid Res. 2001; 42(8):1298-307.
- Olaiz-Fernández G, Rivera-Dommarco J, Shamah-Levy T, Rojas R, Villalpando-Hernández S, Hernández-Avila M, Sepúlveda-Amor J. Encuesta Nacional de Salud y Nutrición 2006. Cuernavaca, México: Instituto Nacional de Salud Pública, 2006. .Available at http://epi.minsal.cl/estudios-y-encuestas-poblacionales/encuestas-poblacionales/encuesta-nacional-de-salud/resultados-ens/. Accessed February 15, 2015.
- Encuesta Nacional de Chile. Available at http:// epi.minsal.cl/estudios-y-encuestas-poblacionales/encuestas-poblacionales/encuesta-nacional-de-salud/resultados-ens/. Accessed February 15, 2015.
- Pichardo R. Estudio de factores de riesgo cardiovascular en la República Dominicana (EFRICARD) 1996-1998.Archivos Dominicanos de Cardiología. 1998; 2:3.
- Miranda JJ, Herrera VM, Chirinos JA, Gómez LF, Perel P, Pichardo R, González et al .Major cardiovascular risk factors in Latin America: a comparison with the United States. The Latin American Consortium of Studies in Obesity (LASO). PLoSOne. 2013; 8(1):e54056.
- Rubinstein AL, Irazola VE, Calandrelli M, Elorriaga N, Gutierrez L, et al. Multiple cardio metabolic risk factors in the Southern Cone of Latin America: A population-based study in Argentina, Chile, and Uruguay Int J Cardiol. 2015 Jan 27; 183C:82-88.
- Medina-Lezama J, Zea-Diaz H, Morey-Vargas OL, Bolaños-Salazar JF, Muñoz-Atahualpa E, et al. Prevalence of the metabolic syndrome in Peruvian Andean hispanics: the PREVENCION study. Diabetes Res Clin Pract. 2007 Nov; 78(2):270-81.
- Quispe R, Benziger CP, Bazo-Alvarez JC, Howe LD, Checkley W, et al. CRONICAS Cohort Study Group. The Relationship between Socioeconomic Status and CV Risk Factors: The CRONICAS Cohort Study of Peruvian Adults. Glob Heart. 2016 Mar; 11(1):121-130.
- Lazo-Porras M, Bernabe-Ortiz A, Málaga G, Gilman RH, Acuña-Villaorduña A, Cardenas-Montero D, Smeeth L, Miranda JJ. Low HDL cholesterol as a cardiovascular risk factor in rural, urban, and rural-urban migrants: PERU MIGRANT cohort study. 2016 Mar; 246:36-43.
- Marcopito LF, Rodrigues SS, Pacheco MA, Shirassu MM, Goldfederer AJ, Moraes MA. Prevalence of a set of risk factors for chronic diseases in the city of São Paulo, Brazil]. Rev Saude Publica. 2005 Oct; 39(5):738-45.
- Garcez MR, Pereira JL, FontanelliMde M, Marchioni DM, Fisberg RM. Prevalence of dyslipidemia according to the nutritional status in a representative sample of São Paulo. Arq Bras Cardiol. 2014 Dec; 103(6):476-84.
- Palomo I, Icaza G, Mujica V, Leiva E, Vásquez M, Alarcón M. Prevalencia de factores de riesgo cardiovascular clásicos en población adulta de Talca, Chile 2005.Rev Med Chile.2007; 135:904–912.
- Meaney A, Ceballos-Reyes G, Gutiérrez-Salmean G, Samaniego-Méndez V, Vela-Huerta A, et al. Cardiovascular risk factors in a Mexican middle-class urban population. The Linda vista Study. Baseline data. Arch Cardiol Mex. 2013 Oct-Dec; 83(4):249-56.
- Garcia-Araujo, M.; Semprún-Fereira, M.; Sulbarán, T.A.; Silva, E.; Calmón, G.; Campos, G. Nutritional and metabolic factors as risk factors for cardiovascular diseases in an adult population in the city of Maracaibo, Estado Zulia, Venezuela. Clin. 2001, 42, 23–42.
- Nieto-Martínez, R.; Hamdy, O.; Marante, D.; Marulanda, M.I.; Marchetti, A.; Hegazi, R.A.; Mechanick, J. I. Transcultural Nutrition Diabetes Algorithm (tDNA): Venezuelan Application. Nutrients 2014, 6, 1333-1363.
- Beltrán-Sánchez H, Harhay MO, Harhay MM, McElligott S. Prevalence and trends of metabolic syndrome in the adult U.S. population, 1999-2010. J Am Coll Cardiol.2013 Aug 20; 62(8):697-703.
- Gavrila D, Salmerón D, Egea-Caparrós JM, Huerta JM, Pérez-Martínez A, Navarro C, Tormo MJ. Prevalence of metabolic syndrome in Murcia Region, a southern European Mediterranean area with low cardiovascular risk and high obesity. BMC Public Health. 2011 Jul 14; 11:562.
- López-Jaramillo P. Pradilla LP. Castillo VR. Lahera V. Patología socio-económica como causa de las diferencias regionales en las prevalencias de síndrome metabólico e hipertensión inducida por el embarazo. Rev Esp Cardiol. 2007; 60(2):168-78.
- López-Jaramillo P, Sánchez RA, Díaz M, Cobos L, Bryce A et al on behalf on the LA Expert Group. Latin American consensus on hypertension in patients with diabetes type 2 and metabolic syndrome. Journal of Hypertension 2013; 31: 223-238.
- Micha R, Khatibzadeh S, Peili NS, Andrews KG, Ezzati M, Mozzafarian D. Global, regional, and national consumption levels of dietary fats and oils in 1990 and 2010: a systematic analysis including 266 country-specific nutrition surveys. BMJ 2014; 348:g2272 doi: 10.1136/bmj.g2272.
- Monteiro CA, Moubarac J-C, Cannon G, Ng S, Popkin BM. Ultra-processed products are becoming dominant in the global food system. Obesity Review 2014, Suppl 2:21-8. doi: 10.1111/obr.12107.
- Moodie R, Stuckler D, Monteiro C, Sheron N, Neal B, Thamarangsi T, et al. Profits and pandemics: prevention of harmful effects of tobacco, alcohol, and ultra-processed food and drink industries. The Lancet 2013; 381(9867):670-679.
- Euromonitor International. Blog.euromonitor.com, 2014, Accessed on March the v21st 2016.
- Aguilar-Salinas C, Cañizales-Quinteros S, Rojas-Martínez R, Mehta R, Villarreal-Molina MT et al. Hypoalphalipoproteinemia in Populations of Native American Ancestry: An Opportunity to Assess the Interaction of Genes and the Environment. Curr Opin Lipidol: 2009; 20(2): 92-97.
- Khalil Ch B. The emerging role of epigenetics in cardiovascular disease Ther Adv Chronic Dis. 2014 Jul; 5(4): 178–187.
- López-Jaramillo P. Lahera V. López-López José. Epidemic of cardiometabolic diseases: a Latin American point of view. Ther Adv Cardiovasc Dis 2011; 5(2):119-131
- Toth PP. Triglyceride-rich lipoproteins as a causal factor for cardiovascular disease. Vascular Health and Risk Management 2016:12 171–183.
- Chapman MJ, Ginsberg HN, Amarenco P, Andreotti F, Boren J, Catapano AL, Descamps OS, Fisher E, Kovanen PT, Kuivenhoven JA, et al. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management. Eur Heart J. 2011; 32:1345–1361.
- Arocha JI, Ponte-Negretti CI, Ablan F, Triglicéridos en ayunas y postprandiales: Su contribución al estudio del riesgo cardiometabólico. Clin Invest Arterioscl. 2009; 21(6):290-7.
- Rashid S, Watanabe T, Sakaue T, Lewis GF. Mechanisms of HDL lowering in insulinresistant, hypertriglyceridemic states: the combined effect of HDL triglyceride enrichment and elevated hepatic lipase activity. Clinical Biochemistry 2003; 36:421–9.
- Ponte-Negretti Carlos I. Redescubriendo los triglicéridos como factor de riesgo cardiovascular; Avances Cardiol 2009; 29(4):367-376).
- Chan DC, Barrett PHR, Ooi EMM, Ji J, Chan DT, Watts GF. Very-low density lipoprotein metabolism and plasma adiponectin as predictors of high-density lipoprotein apolipoprotein A-I kinetics in obese and non-obese men. Journal of Clinical Endocrinology and Metabolism 2009; 94:989–97.
- Ponte-Negretti CI. Triglicérido: El padre de la dislipidemia mixta. En, Aterosclerosis al día VII. Asociación Venezolana de Aterosclerosis- AVA. Soltero I, Edt. Ediciones Dulia 2021 C.A. Caracas, 2009.
- Chan DC, Barrett PHR, Watts GF. Dyslipidemia in visceral obesity: mechanisms, implications, and therapy. American Journal of Caridovascular Drugs 2004; 4:227-246.
- André TA, Després JP. Pathophysiology of human visceral obesity: an update. Physiolological Reviews 2013; 93:359–404.
- Matsumoto M, Han S, Kitamura T, Accili D. Dual role of transcription factor FoxO1in controlling hepatic insulin sensitivity and lipid metabolism. Journal of Clinical Investigation 2006; 116 (9): 2464–2472.
- Brown MS, Goldstein JL. Selective versus total insulin resistance Cell Metabolism 2008; 7:95-96.
- Horton JD, Goldstein JL, Brown MS. SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver. J Clin Invest 2002; 109:1125–1131.
- Mendivil CO, Zheng C, Furtado J, Lel J, Sacks FM. Metabolism of VLDL and LDL containing apolipoprotein C-III and no other small apolipoproteins. Arterioscler Thromb Vasc Biol 2010; 30(2):239.
- Cholesterol Treatment Trialists’ (CTT) Collaborators. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials.Lancet. 2012; 380(9841):581-590.
- Bansal S, Buring JE, Rifai N, Mora S, Sacks FM, Ridker PM. Fasting compared with nonfasting triglycerides and risk of cardiovascular events in women. JAMA. 2007; 298(3):309–316.
- Nordestgaard BG, Benn M, Schnohr P, Tybjaerg-Hansen A. Nonfasting triglycerides and risk of myocardial infarction, ischemic heart disease, and death in men and women. JAMA. 2007; 298(3):299–308.
- Miller M, Cannon CP, Murphy SA, Qin J, Ray KK, et al; PROVE IT-TIMI 22 Investigators. Impact of triglyceride levels beyond low-density lipoprotein cholesterol after acute coronary syndrome in the PROVE IT-TIMI 22 trial. J Am Coll Cardiol. 2008; 51(7):724–730.
- Di Angelantonio E, Sarwar N, Perry P, Kaptoge S, Ray KK, Thompson A. The Emerging Risk Factors Collaboration. Major lipids, apolipoproteins, and risk of vascular disease. JAMA 2009; 302:1993-2000.
- Varbo A, Benn M, Tybjaerg-Hansen A, Jørgensen AB, Frikke-Schmidt R, Nordestgaard BG. Remnant cholesterol as a casual risk factor for ischemic heart disease. J Am Coll Cardiol 2013; 61 (4): 427-436.
- Rosenson RS, Davidson MH, Hirsch BJ, Kathiresan S. Genetics and casuality of Triglyceride-Rich Lipoproteins in Atherosclerotic Cardiovascular Disease. J Am Coll Cardiol 2014; 64 (23): 2525-2540.
- Stammler J, Wentworth D y Neaton JD. Is the relationship between serum cholesterol and risk of premature death from coronary heart disease continuous and graded? The Multipe Risk Factor Intervention Trial. JAMA 1996; 276: 882-888.
- Fruchart JC y Packard CJ. Is cholesterol the major lipoprotein risk factor in coronary heart disease? A Franco-Scottish overview. Cur Med Res Opin 1997; 13:603.
- Walldius G, JungnerI. Apolipoprotein B and Apolipoprotein A-1: risk indicators of coronary heart disease and targets for lipid-modifying therapy. J Intern Med 2004; 255(2):188-205.
- Orringer CE. Non-HDL cholesterol, ApoB and LDL particle concentration in coronary heart disease risk prediction and treatment. Clin Lipidol 2013; 8(1): 69-79.
- Niggon F, Lesnik P, Rouis M, Chapman MJ. Discrete subspecies of human low density lipoproteins are heterogeneous in their interaction with the cellular LDL receptor. J Lipid Research 1991; 33: 1741-1753.
- Björnheden T, Babyi A, Bondjers G, Wiklund O. Accumulation of lipoprotein fractions and subfractions iin the arterial wall determined in an in vitro perfusion system. Atherosclerosis 1996; 123(1-2): 43-56.
- Anber V, Griffin BA, McConnell M, Packard CJ, Shepherd J. Influence of plasma lipid and LDL sub-fraction profile on the interaction between low density lipoprotein with human arterial wall proteoglycans. Atherosclerosis 1996; 124: 261-271.
- Tribble DL, Holl LG , Wood PD y Krauss RM. Variations in oxidative susceptibility among six low density lipoprotein sub-fractions of differing density and particle size. Atherosclerosis 1992; 93(3):189-199.
- Younis NN, Soran H, Pemberton P, Charlton-Menys V, Elseweidy MM, Durrington PN. Small dense LDL is more susceptible to glycation than more buoyant LDL in type 2 diabetes. Clin Science 2013; 124(5):343-349.
- Griffin BA, Lipoprotein atherogenicity: an overview of current mechanisms. Proc Nutrition Soc 1999; 58: 163-169.
- Lamarche B, St Pierre AC, Ruel IL, Cantin B, Dagenais GR, Després JP. A prospective, population-based study of low density lipoprotein particle size as a risk factor for ischemic heart disease in men. Can J Cardiol 2001; 17(8): 859-865.
- Kuller L, Arnold A, Tracy R, Otvos J, Burke G et al. Nuclear magnetic resonance spectroscopy of lipoproteins and risk of coronary heart disease in the Cardiovascular Health Study. Arterioscler Thromb Vasc Biol, 2002; 22: 1175-1180.
- Vakkilainen J, Steiner G, Ansquer J-C, Aubin F, Ratter S, et al. Relationships between low-density lipoprotein particle size, plasma lipoproteins, and progression of coronary artery disease: the Diabetes Atherosclerosis Intervention Study (DAIS). Circulation 2003; 107: 1733-1737.
- Hoogeveen RC, Gaubatz JW, Sun W, Dodge RC Crosby JR et al. Small dense low-density lipoprotein-Cholesterol concentrations predict risk for coronary heart disease. The Atherosclerosis Risk in Communities (ARIC) study. Arterioscler Thromb Vasc Biol 2014; 34: 1069-1077.
- Grammer TB, Kleber ME, März W, Silbernagel G, Siekmeier R et al. Low density lipoprotein particle and mortality: The Ludwigshafen risk and cardiovascular health study. Eur Heart J 2015; 36: 31-38.
- McPherson, R. Remnant Cholesterol“Non-(HDL-C + LDL-C)” as a Coronary Artery Disease Risk Factor. J Am Coll Cardiol. 2013; 61(4):437-439.
- Dallinga-Thie GM, Kroom J, Boren J, Chapman MJ. Triglyceride-rich lipoproteins and remnants: Tagets for therapy? Curr Cardiol Rep 2016; 18 (67): 1-9.
- Boren J, Taskinen MR, Olofsson SO, Levin M. Ectopic lipid storage and insulin resistance: A harmful relationship. J Intern Med 2013; 274: 25-40.
- Takahashi S, Sakai J, Fujimo T, Hattori H, Zenimaru Y et al. The very low-density lipoprotein (VLDL) receptor: characterization and function as a peripheral lipoprotein receptor. J Atheroscler Thromb 2004; 11: 200-208.
- Rapp JH, Lespine A, Hamilton RL, Colyvas N, Chaumeton AH, et al. Triglyceride-rich lipoproteins isolated by selected-affinity anti-apolipoprotein B immunosorption from human atherosclerotic plaque. Arterioscler Thromb Vasc Biol 1994; 14: 1767-1774.
- Proctor SD, Mamo JCL. Retention of fluorescent-labelled chylomicron remnants within the intima of the arterial wall: Evidence that plaque cholesterol may be derived from post-prandial lipoproteins. Eur J Clin Invest 1998; 28: 497-503.
- Alanpovic P, Mack WJ, Knight-Gibson C, Hodis HN. The role of triglyceride-rich lipoprotein families in the progression of atherosclerotic lesions as determined by sequential coronary angiography from a controlled clinical trial. Atheroscler Thromb Vasc Biol 1997; 17: 715-722.
- Goldberg IJ, Bornfeldt KE. Lipids and the Endothelium: bidirectional interactions. Curr Atheroscler Rep 2013; 15(11).
- Libby P. Triglycerides on the rise: should we swap seats on the seesaw? Eur Heart J 2015. Doi:10.1093/eurheartj/ehu500.
- Riwanto M, Rohrer L, Roschitzki B, Beser C, Mocharla P et al. Altered activation of endothelial anti and proapoptotic pathways by high density lipoprotein from patients with coronary artery disease: role of high-density lipoprotein proteome remodeling. Circulation 2013; 127: 891-904.
- Sacks FM, Zheng C, Cohn JS. Complexities of plasma apolipoprotein C-III metabolism. J Lipid Res 2011; 52: 1067-1070.
- Jensen MK, Rimm EB, Furtado JD, Sacks FM. Apolipoptotein C-III as a potential modulator of the association between HDL-cholesterol and incident coronary heart disease. J Am Heart Assoc 2012; 1: jah 3-e000232.
- Sambola A, Osende J, Hathcock J, Degen M, Nemerson Y et al. Role of risk factors in the modulation of tissue factor activity and blood thrombogenicity. Circulation 2003; 107: 973-977.
- Moyer MP, Tracy RP, Tracy PB, van’t Veer C, Sparks CE, Mann KG. Plasma lipoproteins support prothrombinase and other procoagulant enzymatic complexes. Arterioscler Thromb Vasc Biol 1998; 18: 458-465.
- Kohler HP, Grant PJ. Plasminogen-activator inhibitor type 1 and coronary artery disease. N Eng J Med 2000; 342: 1792-1801.
- Rader DJ, Alexander ET, Weibel GL, Billheimer J, Rothblat GH. Role of reverse cholesterol transport in animals and humans and relationship to atherosclerosis. J Lipid Res 2009; 50: S189-S194.
- Mineo C, Deguchi H, Griffin JH, Shaul PW. Endothelial and antithrombotic actions of HDL. Circ Res 2006; 98 (1): 1352-1364.
- Murphy AJ, Woolard KJ, Hoang A, Mukhamedova N, Stirzaker RA et al. High-density lipoprotein reduces the human monocyte inflammatory response. Arterioscler Thromb Vasc Biol 2008; 28: 2071-2077.
- Barter PJ, Baker PW, Rye KA. Effect of high-density lipoproteins on the expression of adhesion molecules in endothelial cells. Current Opinion in Lipidology. 2002; 13:285-8. 89.
- Park SH, Park JH, Kang JS, Kang YH. Involvement of transcription factors in plasma HDL protection against TNF-alpha-induced vascular cell adhesion molecule-1 expression. Int J Biochem Cell Biol. 2003; 35: 168-182.
- Sugano M, Tsuchida K, Makino N. High-density lipoprotein protect endothelial cells from tumor necrosis factor-alpha-induced apoptosis. Biochem Biophys Res Commun. 2000; 272:872-876.
- Calvo C. Bases moleculares de las propiedades antiaterogénicas de las lipoproteínas de alta densidad. Clin Invest Arterioscler 2008; 20 (3): 116-125.
- Nissen SE, Tsunoda T, Tuzcu EM, Schoenhagen P, Cooper C et al. Effect of recombinant ApoA-I Milano on coronary atherosclerosis in patients with acute coronary syndromes: a randomized controlled trial. JAMA 2003; 290; 2292-2300.
- Sirtori CR, Calabresi L, Franceschini G, Baldassarre D, Amato M, et al. Cardiovascular status of carriers of the apolipoprotein A-1 (Milano) mutant: The Limone Sul Garda Study. Circulation 2001; 103: 3047-3050.
- Gordon T, Castelli WP, Hjortland MC, Kannel WB, Dawber TR. High density lipoprotein as a protective factor against coronary heart disease. The Framingham Study. Am J Med 1977; 62: 707-714.
- Di Angelantonio E, Sarwar N, Perry P, Kaptoge S, Ray KK, et al. Major lipids, apolipoproteiins, and risk of vascular disease. JAMA 2009; 302: 1993-2000.
- Gotto AM, Whitney E, Stein EA, Shapiro DF, Clearfield M et al. Relation between baseline and on-treatment lipid parameters and first acute major coronary events in the Air Force/Texas Coronary Atherosclerosis Study (AFCAPS/TexCAPS). Circulation 2000; 101: 477-484.
- Barter PJ, Cauldfield M, Erickson M, Grundy SM, Kastelein JJ, et al. Effects of Torcetrapib in patients at high risk for coronary events. N Eng J Med 2007; 357: 2109-2122.
- AIN HIGH Investigators. Boden WE, Probstfield JL, Anderson T, Chaitman BP, Desvignes-Nickens P, et al. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med. 2011; 365(24):2255–2267.
- Landray MJ, Haynes R, Hopewell JC, Parish S, Aung T et al. HPS-THRIVE Collaborative Group. Effects of extended-release niacin with laropiprant in high-risk patients. N Eng J Med 2014; 371: 203-212.
- Schwartz GG, Olsson AG, Abt M, Ballantyne CM, Barter PJ, et al. On behalf of the dal-OUTCOMES Investigators. Effects of dalcetrapib in patients with a recent acute coronary syndrome. N Eng J Med 2012; 367: 2089-2099.
- Niesor EJ, Schwartz GG, Perez A, Stauffer A, Durwell A et al. Statin-induced decrease in ATP-binding cassette transporter A1 expression via micro-RNA 33 induction may counteract cholesterol efflux to high-density lipoprotein. Cardiovasc Drugs Ther 2015; 29: 7-14.
- Voight BF, Peloso GM, Orho-Melander M, Frikke-Schmidt R, Barbalic M, et al. Plasma HDL cholesterol and risk of myocardial infarction: a Mendelian randomization study. Lancet 2012; 380: 572-580.
- Rosenson RS, Brewer HB Jr, Davidson WS, Fayad ZA, Fuster V et al. Cholesterol efflux and atheroprotection: Advancing the concept of reverse cholesterol transport. Circulation 2012; 125: 1905-1919.
- Martin SS, Khokhar AA, May HT, Kulkarni KR, Blaha MJ et al. HDL cholesterol subclasses, myocardial infarction, and mortality in secondary prevention: the lipoprotein investigators collaborative. Eur Heart J 2015; 36: 22-30.
- Kontush A, Chapman MJ. Functionally defective high-density lipoprotein: a new therapeutic target at the crossroad of dyslipidemia, inflammation and atherosclerosis. Pharmacol Rev 2006; 58: 342-374.
- Rosenson RS, Brewer HB Jr, Ansell BJ, Barter P, Chapman MJ et al. Dysfunctional HDL and atherosclerotic cardiovascular disease. Nat Rev Cardiol 2016; 13: 48-60.
- Micha R, Khatibzadeh S, Pellin S, Fahimi S, Lim S on behalf of the Global Burden of Diseases Nutrition and Chronic Diseases Expert Group (NutriCoDE). Global, regional and national consumption levels of dietary fats and oils in 1990 and 2010: a systematic analysis including 266 country-specific nutrition surveys. BMJ 2014; 348:2272.
- Ultraprocessed foods and drink products in Latin America: Trends, impact on obesity, policy implications. Washington DC: PAHO 2015. ISBN 978-92-75-11864-1-9789275118641).
- López-Santi R. Enfoque terapéutico integral: abordaje no farmacológico. En: Cardiometabolismo, de la fisiopatología a la terapéutica. López-Santi R, Lorenzatti A, Priskorz D. 1er. Edición, 2014.pp: 237-248,
- Estruch R, Ros E, Salas-Salvado J, Covas MI, Corella D, et al. PREDIMED Study Investigators. N Eng J Med 2013; 368: 1279-1290.
- Piepoli MF, Hoes AW, Agewall S, Albus C, Brotons C, et al. Task Force Members 2016. European Guidelines on Cardiovascular Disease Prevention in Clinical Practice. Eur Heart J 2015. Doi: 10.1093/ eurheart/ehw106.
- Organización Panamericana de la Salud. Las américas libres de grasas trans. Declaración de Río de Janeiro. http://www.abia.org.br/anexos/02DeclaracionAGTRioESPANOLFINAL1.pdf.
- Astrup A, Dyerberg J, Elwood P, Hermansen K, HU FB et al. The role of reducing intakes of saturated fats in the prevention of cardiovascular disease: where does the evidence stands in 2010. Am J Clin Nutrition 2011; 93: 684-688.
- World Health Organization. Joint FAO/WHO Expert Consultation on Fats and Fatty Acids in Human Nutrition. WHO, 2008.
- Mozaffarian D. Micha R, Wallace S. Effects on coronary heart disease of increasing polyunsaturated fat in place of saturated fat: a systematic review and meta-analysis of randomized controlled trials. PLoS Med 2010; e1000252.
- Monteiro CA, Cannon G, Levy RB, Moubarac J-C, Jaime P, et al. NOVA,The star shines bright [Food classification. Public health]. World Nutrition January-March 2016; 7 (1-3): 28-38.
- Ultra-processed food and drink products in Latin America: Trends, impact on obesity, policy implications. Washington DC. PAHO, 2015. ISBN 978-92-75-11864-1-9789275118641_en.
- Singh GM, Micha R, Khatibzadeh S, Lim S, Ezzati M, Mozaffarian D. Estimated Global, Regional and National Burdens Related to Sugar-Sweetened Beverage Consumption in 2010. Circulation 2015; 132: 639-666.
- Hu D, Huang J, Wang Y, Zhang D, Qu Y. Fruits and vegetables consumption and risk of stroke: A meta-analysis of prospective cohort studies. Stroke 2014; 45 (6): 1613-1619.
- Soltani S, Shirani F, Chitsazi MJ, Salehi-Abargouei A. The effect of dietary approaches to stop hypertension (DASH) diet on weight and body composition in adults: a systematic review and meta-analysis of randomized controlled clinical trials. Obesity Reviews 2016; doi: 10.1111/obr.12391.
- Chiu S, Bergeron N, Williams PT, Bray GA, Sutherland B, Krauss RM. Comparison of the DASH (Dietary Approaches to Stop Hypertension) diet and a higher-fat DASH diet on blood pressure and lipids and lipoproteins: a randomized controlled trial. Am J Clin Nutr 2016; 103: 341–347.
- Kodama S, Saito K, Tanaka S, Maki M, Yachi Y, Asumi M, Sugawara A, Totsuka K, Shimano H, Ohashi Y, Yamada N, Sone H. Cardiorespiratory fitness as a quantitative predictor of all-cause mortality and cardiovascular events in healthy men and women: a meta-analysis. JAMA 2009; 301: 2024 – 2035.
- Nordestgaard BG, Langsted A, Mora S, Kolovou G, Baum H, et al. Fasting is not routinely required for determination of a lipid profile: clinical and laboratory implications including flagging at desirable concentration cut points – a joint consensus statement from the European Atherosclerosis Society and the European Federation of Clinical Chemistry and Laboratory Medicine. European Heart Journal doi:10.1093/euroheartj/ehw152.
- Friedewald VE, Jones PH, Mason P, Roberts R, Weintraub H. The Editor´s Round Table: Current Perspectives on Triglycerides and Atherosclerosis. Am J Cardiol 2016; 117 (10): 1697-1702.
- Stamler J, Wentworth D, Neaton JD, for the MRFIT Research Group. Is relationship between serum cholesterol and risk of premature death from coronary heart disease continuous and graded? Findings in 356 222 primary screens of the Multiple Risk Factor Intervention Trial (MRFIT) JAMA 1986; 256:2823-2828.
- Collins R, Reith C, Emberson J, Armitage J, Baigent C, et al. Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet 2016; Published on line September 8th http:// dx. doi.org/10.1016/S0140-6736 (1631357-5).
- Catapano AN, Graham I, De Backer G, Wiklund O, Chapman MJ, et al on behalf of the Authors/Task Force Members. 2016 ESC/EAS Guidelines for the management of dyslipidemia. 2016. DOI: http:// dx.doi.org/10.1093/eurheartj/ejw272. Published on line August the 27th
- Stone NJ, Robinson J, Lichtenstein AH, Merz CNB, Blum CB, et al. 2013 ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 129: S1 –S45.
- Ponte C. Arocha J, Isea-P J, Gomez-M JR, Abblan F, Machado L, Colan J: III Consenso Venezolano para el Manejo del Paciente con Dislipidemia. Avances Cardiológicos: Vol 34, Supl 1. 2014.
- Ben-Yehuda O, De Maria A. LDL Cholesterol Targets after the ACC/AHA 2013 Guidelines: Evidence That Lower is Better? J Am Coll Cardiol 2014; 64: 495-497.
- Boekholdt S, Hovingh G, Mora S, Arsenault B, Amarenco P, Pedersen T, La Rosa J et al. Very Low Levels of Atherogenic Lipoproteins and the Risk for Cardiovascular Events a Meta-Analysis of Statins Trials. J Am Coll Cardiol 2014; 64: 485-494.
- Cannon C, Blazing M, Giugliano R, Mc Cagg A, White J, Theroux P et al. Ezetimibe added to Statin Therapy after Acute Coronary Syndromes. N Eng J Med2015; 372:2387-2397.
- Brunzell J, Howard B, Davison, Stein J, Furberg C et al. Lipoprotein Management in Patients with Cardio-metabolic Risk. J Am Coll Cardiol 2008; 51:1512-1524.
- Miller M, Hinsberg H y Schaefer E. Relative Atherogenicity and Predictive Value of Non High Density Lipoprotein Cholesterol for Coronary Heart Disease. Am J Cardiol 2008; 101:1003-1008.
- Ballantyne CM, Bertolami M, Hernandez Garcia H, Nul D, Stein E, Theroux P, Weiss R et al Achieving LDL cholesterol, non-HDL cholesterol, and apolipoprotein B target levels in high-risk patients: Measuring Effective Reductions in Cholesterol Using Rosuvastatin therapy (MERCURY) II.J Am CollCardiol2008; 52: 626-32.
- Carmena R, Duriez P, Fruchart J. Atherosclerosis: Evolving Vascular Biology and Clinical Implications. Atherogenic Lipoprotein Particles in Atherosclerosis. Circulation 2004; 109: (supple III):III2-III7.
- Sniderman A, Williams K, Contois J, Monroe H, McQueen M, de Graaf J, Furberg. A Meta-Analysis of Low –Density Lipoprotein Cholesterol, Non-High Density Lipoprotein Cholesterol, and Apolipoprotein B as Markers of Cardiovacular Risk. Circ Cardiovasc Qual Outcomes 2011; 4:337-345.
- Carroll M, Kit B, Lacher D. Trends in elevated triglyceride in adults: United States, 2001–2012. NCHS Data Brief. 2015;198:198.
- Miller M, Stone NJ, Ballantyne C, Bittner J, Criqui MH, et al. Triglycerides and cardiovascular disease: a scientific statement from the American Heart Association. Circulation. 2011; 123(20):2292–2333.
- Keech A, Simes RJ, Barter P, et al on behalf of the FIELD Investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomized controlled trial. Lancet. 2005; 366(9500):1849–1861.
- Frick MH, Elo O, Haapa K, Heinonen OP, Heinsalmi P, et al. Helsinki Heart Study: primary-prevention trial with gemfibrozil in middle-aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease. N Engl J Med. 1987; 317(20):1237–1245.
- The BIP Study Group. Secondary prevention by raising HDL cholesterol and reducing triglycerides in patients with coronary artery disease. The Bezafibrate Infarction Prevention (BIP) study. Circulation. 2000; 102(1):21–27.
- Rubins HB, Robins SJ, Collins D, Fye CL, Anderson JW, et al. Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial Study Group. N Engl J Med. 1999; 341(6):410–418.
- Jun M, Foote C, Lv J, Neal B, Patel A, et al. Effects of fibrates on cardiovascular outcomes: a systematic review and meta-analysis. Lancet. 2010; 375(9729):1875–1884.
- Lee M, Saver JL, Towfighi A, Chow J, Ovbiagele B. Efficacy of fibrates for cardiovascular risk reduction in persons with atherogenic dyslipidemia: a meta-analysis. Atherosclerosis. 2011; 217(2):492–498.
- Lee MW, Park JK, Hong JW, Kim KJ, Shin DY, et al. Beneficial Effects of Omega-3 FA on Low Density Lipoprotein Particle Size in Patients with Type 2 Diabetes Already under Statin Therapy.Diabetes & Metabolism Journal. 2013; 37(3):207-211.
- Rauch B, Schiele R, Schneider S, Diller F, Victor N, et al. OMEGA, a randomized, placebo-controlled trial to test the effect of highly purified omega-3 fatty acids on top of modern guideline-adjusted therapy after a myocardial infarction. Circulation. 2010; 122(21):2152–2159.
- Kromhout D, Giltay EJ, Geleijnse JM, Alpha Omega Trial Group. n-3 fatty acids and cardiovascular events after myocardial infarction. N Engl J Med. 2010; 363(21):2015–2026.
- Kotwal S, Jun M, Sullivan D, Perkovic V, Neal B. Omega 3 fatty acids and cardiovascular outcomes: systematic review and meta-analysis. Circ Cardiovasc Qual Outcomes. 2012; 5(6):808–818.
- GISSI-Prevenzione Investigators. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Gruppo Italiano per lo Studio della Sopravvivenza. Lancet. 1999; 354(9177):447–455.
- Yokoyama M, Origasa H, Matsuzaki M, Matsusawa Y, Saito Y, et al. Effects of eicosapentaenoic acid on major coronary events in hypercholesterolaemic patients (JELIS): a randomised open-label, blinded endpoint analysis. Lancet. 2007; 369(9567):1090–1098.
- The ORIGIN Trial Investigators, n-3 FA and Cardiovascular Outcomes in Patients with Dysglycemia, N Eng J Med 2012; 367: 309-318.
- gov. [webpage on the Internet]. Outcomes Study to Assess Statin Residual Risk Reduction with Epanova in High CV Risk Patients with Hypertriglyceridemia (STRENGTH). 2015. Available from: https://clinicaltrials.gov/ct2/show/NCT02104817. Accessed August 20, 2015.
- Ballantyne CM, Bays HE, Kastelein JJ, Stein E, Issacsohn SL, Braeckman RA, Soni PN. Efficacy and safety of eicosapentaenoic acid ethyl ester (AMR101) therapy in statin-treated patients with persistent high triglycerides (from the ANCHOR study). Am J Cardiol. 2012; 110(7):984–992.
- Harris WS, Ginsberg HN, Arunakul N, Shachteer NS, Windsor SL, et al. Safety and efficacy of Omacor in severe hypertriglyceridemia. J Cardiovasc Risk. 1997; 4(5–6):385–391.
- Filion KB, El Khoury F, Bielinski M, Schiller I, Dendukuri N, Brophy JM. Omega-3 fatty acids in high-risk cardiovascular patients: a meta-analysis of randomized controlled trials. BMC Cardiovasc Disord. 2010; 10:24.
- HPS2-THRIVE Collaborative Group. HPS2-THRIVE randomized placebo-controlled trial in 25 673 high-risk patients of ER niacin/laropiprant: trial design, pre-specified muscle and liver outcomes, and reasons for stopping study treatment. Eur Heart J. 2013; 34(17):1279–1291.
- Lavigne PM, Karas RH. The current state of niacin in cardiovascular disease prevention: a systematic review and meta-regression. J Am Coll Cardiol. 2013; 61(4):440–446.
- Canner PL, Berge KG, Wenger NK, J, Stamler J, Friedman L, Prineas RJ, Friedewald D. Fifteen year mortality in coronary drug project patients: long-term benefit with niacin. J Am Coll Cardiol. 1986; 8(6):1245–1255.
- Bruckert E, Labreuche J, Amarenco P. Meta-analysis of the effect of nicotinic acid alone or in combination on cardiovascular events and atherosclerosis. Atherosclerosis. 2010; 210(2):353–361.
- Guyton JR, Slee AE, Anderson T, Fleg JL, Goldberg RB, et al. Relationship of lipoproteins to cardiovascular events: the AIM-HIGH Trial (atherothrombosis intervention in metabolic syndrome with low HDL/high triglycerides and impact on global health outcomes). J Am Coll Cardiol. 2013; 62(17):1580–1584.
- Guyton JR, Bays HE. Safety considerations with niacin therapy. Am J Cardiol. 2007; 99(6A):22C–31C.
- Birjmohun RS, Hutten BA, Kastelein JJ, Stroes ES. Efficacy and safety of high-density lipoprotein cholesterol-increasing compounds: a meta-analysis of randomized controlled trials. J Am Coll Cardiol. 2005; 45(2):185–197.
- Volpe M, Erhardt LR, Williams B. Managing cardiovascular risk: the need for change. J Hum Hypertens. 2008; 22:154–7.
- Maki KC, Bays HE, Dicklin MR. Treatment options for the management of hypertriglyceridemia: Strategies based on the best-available evidence. J Clin Lipidol 2012; 6(5): 413-426.
- Driver SL, Martin SS, Gluckman TJ, Clary JM, Blumenthal RD, Stone NS. Fasting or nonfasting lipid measurements. It depends on the question. Journal of American College of Cardiology 2016; 67:1227-1234.
- Sarwar N, Danesh J, Eiriksdottir G, Sigurdsson G, Wareham N, et al. Triglycerides and the risk of coronary heart disease: 10,158 incident cases among 262.525 patients in 29 Western prospective studies. Circulation 2007; 115:450–458.
- Boekholdt SM, Arsenault BJ, Mora S, Pedersen TR, LaRosa JC, et al. Association of LDL cholesterol, non-HDL cholesterol, and apolipoprotein B levels with risk of cardiovascular events among patients treated with statins. JAMA 2012; 307(12):1302–1309.
- Preiss D, Tikkanen MJ, Welsh P, Ford I, Lovato LC, et al. Lipid-Modifying Therapies and Risk of Pancreatitis. A Meta-analysis. JAMA 2012; 308 (8): 804-811.
- Batsis JA, Lopez-Jimenez F. Cardiovascular risk assessment: From individual risk prediction to estimation of global risk and change in risk in the population. BMJ Medicine 2010; 108:29. DOI: 10.1186/1741-7015-8-29.
- Grover S, Lowensteyn I. The challenges and benefits of cardiovascular risk assessment in clinical practice. Can J Cardiol 2011, 27 (4): 481-487.
- D’Agostino RB Sr, Grundy S, Sullivan LM, Wilson P. Validation of the Framingham coronary heart disease prediction scores: results of a multiple ethnic groups investigation. JAMA. 2001 Jul 11; 286(2):180-7.
- Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project European Heart Journal 2003; 24:987-1003.
- McGorrian C. Yusuf S. Islam S. Rangarajan S. Avezum A. in behalf Interheart Investigators. Estimating modifiable coronary heart disease risk in multiple regions of the world: the INTERHEART Modifiable Risk Score. European Heart Journal (2011) 32, 581–590.
- Goff DC, Lloyd-Jones DM, Bennett G, Coady S, D’Agostino RB, et al. 2013 ACC/AHA Guideline on the Assessment of Cardiovascular Risk. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2014; 63: 2935–59.
- Kotwal S, Jun M, Sullivan D, Perkovic V, Neal B. Omega 3 Fatty Acids and cardiovascular outcomes: Systematic review and Meta-Analysis. Circulation Cardiovasc Qual Outcomes 2012; 5: 808 – 818.
- Evangelos CR; Evangelia EN. Association between Omega 3 fatty acid supplementation and risks of major cardiovascular disease events. JAMA. 2012; 308(10):1024-103.
- Rosenblit PD. Do persons with diabetes benefit from combination statin and fibrate therapy? Curr Cardiol Rep.2012 Feb; 14(1):112-24.
1 comment




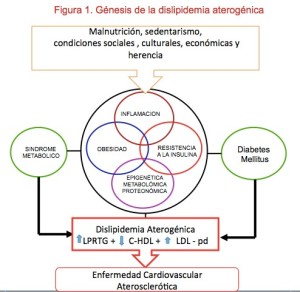
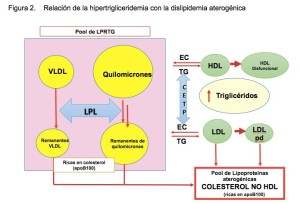

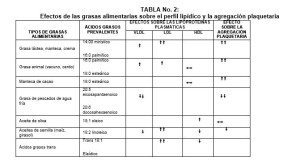
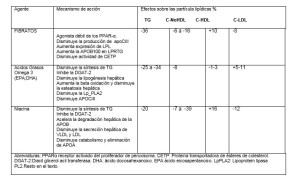
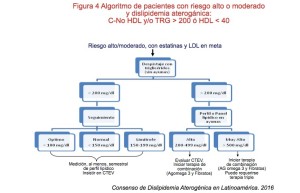






































1 Comment
Raquel Oropeza
noviembre 18, 2019, 2:36 amLDL favor de revisar la traducción. Por favor revise, hasta donde sé LD es de "Low Density" o sea de Baja densidad, No densa sino lo contrario. Pero no soy experta por favooor revise.
REPLY