Estudio PARTNER 3 de Tomografía Computada La era del implante de prótesis aórtica por vía percutánea (TAVI) fue posiblemente una revolución en el tratamiento de la estenosis aórtica, comenzando en pacientes inoperables o de muy alto riesgo, para finalmente extenderse a poblaciones de riesgo intermedio y bajo, con resultados equiparables a la cirugía convencional. La
Estudio PARTNER 3 de Tomografía Computada
La era del implante de prótesis aórtica por vía percutánea (TAVI) fue posiblemente una revolución en el tratamiento de la estenosis aórtica, comenzando en pacientes inoperables o de muy alto riesgo, para finalmente extenderse a poblaciones de riesgo intermedio y bajo, con resultados equiparables a la cirugía convencional. La técnica no está exenta de complicaciones propias del procedimiento, y otras compartidas con la cirugía, aunque con incidencia diferente (1-5)
A partir de algunos reportes, en particular relacionados a eventos embólicos alejados del procedimiento o incremento de los gradientes, se detectaron cambios estructurales en las prótesis implantadas sugestivos de trombosis post implante.
Esta situación generó alarma en la comunidad cardiológica, realizándose estudios de imagen (ecocardiografía transesofágica y principalmente tomografía 4D), dirigidos a detectar la presencia de trombosis, aún sin traducción clínica.
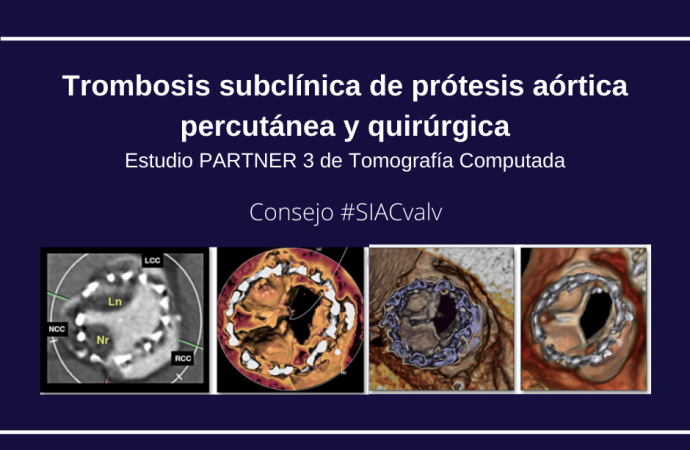
La tomografía 4D permite sospechar trombosis cuando se detectan determinados hallazgos: la presencia de engrosamiento diastólico de uno o más leaflets (HALT, por sus siglas en inglés), la reducción de excursión sistólica de uno más leaflets (RELM, por sus siglas en inglés) y la combinación de ambos (hipoatenuación que afecta el movimiento, HAM) (6)
Estos hallazgos se pueden encontrar en pacientes con eventos clínicos relacionados con la trombosis (embolia, insuficiencia cardíaca aguda) o en casos de aumento de los gradientes en estudios de control, pero esta situación es infrecuente. Sin embargo, cuando se realizan tomografías en forma sistemática su prevalencia es mucho mayor, concluyendo que la trombosis subclínica es una entidad prevalente.
Diferentes estudios han estimado una prevalencia de trombosis clínica menor al 1%, pero subclínica mucho mayor, con porcentajes variables en los diferentes registros, entre el 13 y el 40%. Una revisión sistemática de 18 estudios que incluyeron 11124 pacientes, reporta una incidencia global de trombosis de 0.43%/mes (IC95% 0.21-0.72%; 5.16%/año); con una incidencia de trombosis subclínica de 1.36%/mes (IC95% 0.71-2.19; 16.32%/año) y clínica de 0.04%/mes (IC95% 0.00-0.19; 0.48%/año) (7)
En el estudio de Makkar R y cols (8), los autores evalúan una cohorte de pacientes del estudio PARTNER 3, que comparó TAVI versus cirugía convencional en pacientes de bajo riesgo quirúrgico. Este subestudio tomográfico comparó 221 pacientes sometidos a TAVI con 214 derivados a reemplazo quirúrgico, en quienes se realizó una tomografía 4D a los 30 días y al año. En total, 10% tuvieron HALT (signo de trombosis por tomografía) a 30 días y 24% al año, siendo mayor la prevalencia en la rama TAVI a 30 días (13 vs 5%, RR 2.64; IC95%1.11-6.32) pero no al año (28 vs 20%, RR 1.38; IC95% 0.87-2.18). Pese a la presencia de trombosis, 56% de los pacientes mostró resolución espontánea sin anticoagulación al año; mientras que en aquellos sin evidencia de trombosis al mes, un 21% mostró signos tomográficos (HALT) al año, sin diferencia entre las prótesis percutáneas y quirúrgicas.
Aquellos pacientes con HALT a 30 días y al año tuvieron gradientes significativamente más elevados (17.8 ± 2.2 vs. 12.7 ± 0.3; p = 0.04). A 30 días, los pacientes con HALT tuvieron mayores tasas de accidente cerebrovascular (ACV), accidente isquémico transitorio (TIA) y complicaciones tromboembólicas (8.6% vs. 1.6%; RR: 5.3; IC95%: 1.3-21.4); muerte, ACV, TIA y complicaciones tromboembólicas (8.6% vs. 2.9%; RR: 3.0; IC95%: 0.8-10.4), y trombosis clínica (8.6% vs 0.3%; RR: 26.7; IC95% CI: 2.8- 249.4). En lo que respecta a los predictores de trombosis, el TAVI (vs cirugía) fue predictor a 30 días (pero no al año), mientras que el porcentaje de oversizing fue predictor al año. Este trabajo básicamente muestra que está situación es relativamente prevalente, dinámica (un 50% resuelve espontáneamente al año mientras que 20% sin trombosis desarrolla algún signo de ésta). El estudio también sugiere que la presencia de trombosis subclínica está relacionada con mayor riesgo de eventos tromboembólicos. Si bien los pacientes sometidos a TAVI tendrían mayores tasas de trombosis al mes, esta diferencia no es significativa al año.
Aunque estudios previos sugieren un beneficio de la anticoagulación para prevenir trombosis protésica, el estudio GALILEO (9) mostró que el uso del anticoagulación (Rivaroxaban 10 mg más aspirina) comparado con doble antiagregación convencional aumentaba el riesgo de complicaciones tromboembólicas y sangrado, pese a una reducción de los signos de trombosis tomográficos en la rama Rivaroxaban (GALILEO 4D). (10)
En conclusión, la presencia de trombosis subclínica detectada en estudios tomográficos sistemáticos es relativamente frecuente tanto en prótesis percutáneas como quirúrgicas, dinámica (algunos resuelven espontáneamente mientras que otros progresan o desarrollan nueva trombosis), posiblemente se asocia a mayor riesgo de complicaciones tromboembólicas pero sin claro beneficio de utilización de anticoagulación sistemática. No está claro aún si estos signos de trombosis subclínica pueden traducirse en un deterioro estructural precoz y consecuentemente menor durabilidad de las prótesis.
Ver link AQUI
Bibliografía:
1.Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med 2010;363:1597-607.
2.Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med 2011;364:2187-98.
3.Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med 2016;374:1609-20.
4.Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med 2019;380:1695-1705.
5.Popma J, Deeb G, Yakubov S, et al. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med 2019;380:1706-1715.
6.Jilaihawi H, Asch FM, Manasse E, et al. Systematic CT Methodology for the Evaluation of Subclinical Leaflet Thrombosis. JACC Cardiovasc Imaging 2017;10:461-470.
7.D’Ascenzo F, Salizzoni S, Saglietto A, et al. Incidence, predictors and cerebrovascular consequences of leaflet thrombosis after transcatheter aortic valve implantation: a systematic review and meta-analysis. Eur J Cardiothorac Surg 2019;56:488-494.
8.Makkar R, Blanke P, Leipsic J, et al. Subclinical Leaflet Thrombosis in Transcatheter and Surgical Bioprosthetic Valves. J Am Coll Cardiol 2020;75:3003–15.
9.Dangas G, Tijssen J, Wöhrle J, et al. A Controlled Trial of Rivaroxaban after Transcatheter Aortic-Valve Replacement. N Engl J Med 2020;382:120-129.
10.De Backer O, Dangas G, Jilaihawi H, et al. Reduced Leaflet Motion after Transcatheter Aortic-Valve Replacement. N Engl J Med 2020;382:130-139.









































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados