“La mejor mentira era aquella que contenía cierta dosis de verdad.”. Del libro La sombra de la sirena por Camilla Läckberg. Nota: Esta es una opinión personal del autor y no representa la visión de la SIAC. Introducción El prolapso de valvular mitral (PVM) es una anormalidad muy común con una prevalencia de cercana
“La mejor mentira era aquella que contenía cierta dosis de verdad.”. Del libro La sombra de la sirena por Camilla Läckberg.
Nota: Esta es una opinión personal del autor y no representa la visión de la SIAC.
Introducción
El prolapso de valvular mitral (PVM) es una anormalidad muy común con una prevalencia de cercana a 2-3% en población no seleccionada (1) con una penetrancia aproximada entre familiares de primer orden de 5-20% (2).(3)
Desde su descripción inicial por Barlow en 1968, las arritmias se han asociado a este desorden. (4) Algunos estudios han mostrado una elevada tasa de muerte súbita de 0.2–0.4% cercana a 2 veces la población general. (5) (6)
Inicialmente se prestó atención a los pacientes con ruptura de cuerdas tendinosa con regurgitación mitral severa donde se reportó una tasa de muerte súbita de 1.8%(7), y este riesgo esta asociado a clase funcional (1% en clase funcional I y 7.8% en clases III/IV)(7). Luego se encontró que solo la presencia de válvulas redundantes con grosor > 5 mm era la única variable asociado a muerte súbita(6).
Argumento a favor
Desde el inicio de esta década, la atención se volcó sobre los pacientes con PVM sin regurgitación significativa (menor de moderada) con función ventricular normal y el riesgo de muerte súbita; pero no fue hasta 2013 que se describió un subgrupo de pacientes con PVM con características “malignas”. El estudio fue una serie amplia de 1200 casos de muerte súbita, 2% eran idiopática sin miocardiopatías ni canalopatias ni isquemia y llamativamente, 42% de este grupo tenían PVM, 90% comprometían ambas valvas, 90% eran mujeres, 78% tenían onda T invertida o asimétrica, con 100% de bigeminismo ventricular y 78% de taquicardia ventricular (TV) y EVs de los tractos que alternaban con TV fasciculares en el 78% de los casos(8). Después de una media de seguimiento de 1.8 años desde el implante del DAI, aproximadamente 54% recibieron descargas apropiadas y solo el PVM de ambas valvas, se asoció con FV recurrente(8).
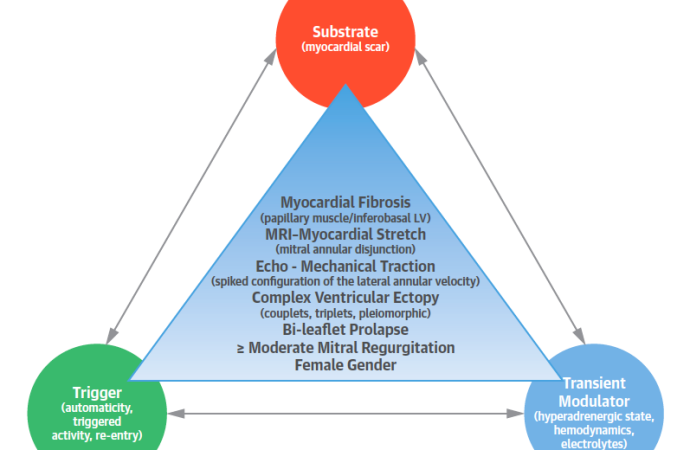
Esta descripción reavivó el interés en definir mucho mejor este subgrupo de pacientes y en 2015 Basso y cols describieron en un estudio de 650 muertes súbitas en menores de 40 años, que el 7% tenían PVM y establecieron un nuevo síndrome con elevado riesgo de muerte súbita asociado a PVM caracterizado por a) PVM de ambas valvas 70% b) Género femenino c) Onda T invertida en cara inferior 83% y d) Extrasístoles ventriculares complejas o taquicardia ventricular con bloqueo de rama derecha o polimórfica o fibrilación ventricular. Todos los pacientes de esta serie tenían fibrosis a nivel de los musculos papilares (MPs) en anatomía patológica y estudio de realce tardío por resonancia magnética, y en 88% de los casos en la región inferobasal del ventrículo izquierdo (9).
En sintonía con lo previamente publicado, recientemente, Garbi y cols describieron 68 muertes súbitas asociadas a PVM tipo Barlow con fibrosis focal más que difusa y en todos los casos involucraba el músculo papilar posterior y 10% tenia fibrosis focal en el ventrículo derecho, sugiriendo la asociación de la enfermedad de Barlow con una forma de miocardiopatía con compromiso biventricular. (10)
Varias descripciones anecdóticas han mostrado supresión completa de los cambios electrocardiográficos basales o de arritmia graves posterior a la cirugía mitral, evidenciando la naturaleza arritmogénica, al menos en algunos casos particulares (11)(12)(13).
Dado estos hallazgos se ha teorizado que la tensión que produce el prolapso sobre el musculo papilar posteromedial y la pared inferior induce fibrosis subvalvular, siendo éste el sustrato anatómico de las arritmias letales.
Más recientemente los estudios con resonancia magnética nuclear con realce tardío con gadolinio y T1 mapping han permitido reconocer al PVM como una enfermedad fibrosante, con mayor tendencia a producir fibrosis que otras etiologías de insuficiencia mitral al mismo grado de severidad de la regurgitación y se ha detectado fibrosis intersticial con T1 mapping en el 91% y entre el 35-50% fibrosis focal en los estudios con realce tardío(14)(15). La zona de fibrosis suele comprometer el aparato subvalvular y la región alrededor de los papilares, aunque se ha detectado en cualquier región del ventrículo izquierdo (VI). (12) La mayoría de los pacientes (74%) muere durante el reposo o el sueño. (9) (19)
La fibrosis intersticial detectada por T1 mapping ha sido relacionada con disfunción sistólica global subclínica y puede ser el origen de arritmias ventricular, aún sin tener fibrosis focal detectada por realce tardío con gadolinio.(16)
Argumentos en contra
Para caracterizar un grupo de riesgo de una enfermedad, los elementos que componen ese subgrupo deben reiterarse en forma consistente y estos estar asociados a desenlaces finales.
¿Toda la información disponible, permite sentar en el banquillo de los acusados al PVM?
¿Es consistente la información obtenida de los diferentes estudios?
¿los músculos papilares y la región circundante son el sustrato anatómico para la generación de arritmias ventriculares en todos pacientes con PVM?
¿Tienen realce tardío en los musculo papilares y la pared inferior basal los pacientes con PVM sometidos a estudios electrofisiológicos?
Syed y cols , cruzaron la información de dos bases de datos, de ablaciones de TV y ecocardiografía con diagnóstico de PVM, ayudando a conocer que tipo arritmia ventricular graves tenían estos pacientes y el sustrato anatómico. Estudiaron 14 pacientes, 6 con muerte súbita abortada y 8 con TV. El sitio predominante de las EV/TV fueron las fibras of Purkinje (79%) y estos fueron distribuidos en el musculo papilar (MP) en 18%, fasciculares en 36% y mixto en 45%. También involucró el anillo mitral en 14% y los tractos de salida en 29% (17). La mayor parte de las arritmias ventriculares inducibles en este estudio pueden ser catalogadas como primarias o idiopáticas (fasciculares 36% y tracto de salida de ventrículo derecho 30%), ósea las arritmias ventriculares graves que usualmente comprometen los corazones estructuralmente normales y difícilmente atribuible a PVM. ¿Será que el prolapso era un espectador inocente a la arritmia ventricular grave idiopática?
El estudio de Syed y cols también mostró decepcionantemente que la mayor parte de las arritmias ventriculares no están asociadas a fibrosis en la resonancia, al menos en esta pequeña serie de casos (solo 6 de 14 tenían estudio de realce)
Una pieza más del rompecabezas que se ha introducido en años recientes, es la llamada disyunción del anillo mitral (DAM), condición que algunos autores han relacionado con el origen de arritmia letales. (20) (21)
Pero ¿La DAM eleva el riesgo de arritmia letales en presencia de PVM?
Dejgaard y cols demostraron recientemente que, la prevalencia de arritmia ventriculares malignas no fue mayor en el grupo con PVM, sugiriendo que la DAM es una condición de riesgo, que puede estar o no asociada al PVM (20). Pero Angelini y cols describieron esta condición como una variante normal cuando se analizan varios segmentos del anillo mitral en muestras de anatomía patológica y existe en la misma proporción en la población normal, como en los pacientes con prolapso (22)(23).
Pero ¿Qué otras evidencias tenemos a favor de la naturaleza benigna de las arritmias ventriculares en PVM?
Un estudio longitudinal en pacientes con elevada carga de extrasístoles ventriculares mostró que aquellos con PVM tenían una frecuencia similar de EVs y un pronóstico y sobrevida igual que los pacientes sin PVM.(24)
Otro estudio retrospectivo de cohorte pareado de 18.796 pacientes de Mayo Clinic, demostró que los pacientes con PVM de ambas valvas, tienen un aumento de extrasístole ventricular pero paradójicamente está asociado con mejoría de la sobrevida comparado con PVM de una sola valva o con los controles (25).
Otros factores asociados a muerte súbita en PVM
No es de extrañar, que al igual que la población no seleccionada, los pacientes con PVM, tengan canalopatias, síndrome QT largo, QT corto, pre-excitación oculta o vías anómalas, enfermedad arterial coronaria o miocarditis que pueden producir arritmia ventriculares malignas e incrementar el riesgo de muerte súbita. Estas arritmias malignas determinadas genéticamente se han demostrado en 27% de las muertes súbitas de la población general menores de 35 a. (26)
Otros sustratos de arritmia ventriculares graves, como la repolarización precoz se ha asociado a PVM. La dispersión del QT puede elevar el potencial arritmogénico de esta condición (27).
Se ha descrito que el 2% de la población con Síndrome QT largo tienen PVM, con una prevalencia similar a la población general, y con el subsecuente riesgo elevado de muerte súbita (28).
Es clásicamente conocido que los PVM presentan, mas vías accesorias izquierdas ocultas que la población general; en un estudio aproximadamente el 13% de los pacientes que se le realización estimulación electrofisiológica programada por palpitaciones o sincope tenían un haz anómalo oculto, siendo izquierdo en el 8% y 5% paraseptales. Otro estudio evidenció vías anómalas en 22% de los pacientes con taquicardia supraventricular paroxística (29).
Existen otras condiciones que se cree pueden elevar el riesgo de arritmias malignas, como la enfermedad de pequeños vasos intramiocardico sobre todo displasia fibromuscular que se ha observado en los exámenes patológico en el 75% de los casos (29). Esta variante se ha asociado con fibrosis del septum interventricular basal. (30).
Estudios de autopsia en la década de los 80 mostraron que aproximadamente 90% de las muertes súbitas tenían lesión endocardicas de fricción en el ventrículo izquierdo y 36% presentaban agregados de plaqueta y fibrina en el ángulo entre la valva posterior y la pared de la aurícula izquierda que pueden favorecer la embolizacion. (31). Al mismo tiempo aproximadamente 35% tienen necrosis quística de la capa media probablemente en relación al PVM sindromático (31)(32)
Una o mas de estas condiciones pueden coexistir favoreciendo el riesgo de muerte súbita en una minora de los casos.
De allí que es mandatorio descartar todas estas posibilidades en pacientes con PVM y arritmias ventriculares malignas para guiar la toma de decisiones terapéuticas individualizadas.
Conclusiones: Llamado a la cautela
Debido a que el PVM es muy común y la muerte súbita de estos pacientes es muy rara, es poco probable que el PVM por si solo sea un poderoso predictor de riesgo. Para nosotros es muy difícil atribuir muerte súbita a una enfermedad tan prevalente 2-3% de la población mundial con series muy pequeña de pacientes de muerte súbita. Por eso las preguntas siempre son
– ¿Será una relación causal o casual?
– ¿Son arritmias ventriculares primarias la causa de la muerte súbita en el contexto de una condición muy prevalente?
– ¿Será el prolapso un espectador inocente de una arritmia ventricular maligna idiopática?
– ¿Existe otro sustrato que provoquen la arritmia?
Estas preguntas toman mas vigencia, cuando existen múltiples series de muerte súbita sometidas a autopsia sin descripción de prolapso de válvula mitral y al igual que series de pacientes con muerte súbita abortada con estudios de resonancia magnética cardiaca sin anormalidades descritas en la válvula mitral (33)(34)(35)(36)(37).
Aunque no hay una guía de actuación clínica de ninguna sociedad sobre la estratificación de riesgo de muerte súbita en PVM, es lógico no minimizar ni exagerar dicho riesgo en los pacientes individuales, ya que esta última puede producir obvios trastornos de ansiedad en estos pacientes, que ya de por si tienden a tener más ataques de pánico que la población general.
Es recomendable la evaluación por especialistas en electrofisiología expertos en arritmias ventriculares, sobre todo si el paciente presenta prolapso valvular mitral arritmogénico descrito por Basso y cols. Es indispensable el uso racional de las imágenes debido a que la detección del síndrome de PVM arritmogénico, pudiera tener un coste muy elevado si se utilizan el eco, holter, prueba de esfuerzo y resonancia como métodos de screening de este subgrupo de pacientes, como han sugerido Basso y cols (38)(39). Además, esta teoría no se ha estudiado prospectivamente. Los estudios genéticos para determinar pacientes con alto riesgo individual seguramente serán utilizados en el futuro, especialmente por la asociación familiar y hereditaria de esta patología. (40)(41)(42)
En caso que el paciente requiera estudio electrofisiológico por taquicardia ventricular sostenida, alta densidad de arritmia ventriculares > 15% o muerte súbita abortada o miocardiopatía inducida por las extrasístoles frecuentes, es recomendado realizar estudio de cardioresonancia con realce tardío y T1 mapping para evaluar la posibilidad de sustrato anatómico bajo, el protocolo usual de cualquier taquicardia ventricular clínicamente importante.
Lejos estamos de caracterizar el subgrupo de pacientes con PVM con elevado riesgo de muerte súbita en forma precisa como, para indicar un desfibrilador automático implantable (DAI) en forma profiláctica primaria.
Es necesario diseñar un estudio con seguimiento largo plazo de pacientes con PVM y un grupo control, con evaluación genética de las canalopatias, síndrome QT largo, corto y otras arritmias determinadas genéticamente, además de resonancia magnética nuclear con realce tardío con gadolinio y T1 mapping buscando las muchas piezas faltantes de este complejo y excepcional rompecabezas.
Mensaje central
1- La informacion sobre la asociacion de muerte súbita y PVM es contradictoria y antagónica
2- Los pacientes a quienes se les detecte Síndrome de PVM arritmogénico con EV o TV sobre todo con imagen de rama derecha, deben se referido con electrofisologia para su estratificación.
3- Los pacientes con PVM familiar y antecedentes de muerte sñubita requiere evaluar la presencia de PVM sindromñatico y deben estudiarse la asociación con arritmia determinadas genéticamente y otras alteraciones morfolñogicas ( miocardiopatia , aortopatia, etc)
4- No existe estudios aleorizados sobre el impacto de la medicación sobre la MS en PVM
5- No existe ningún estudio que soporte el uso de DAI en prevención primaria en PVM
6- Existe una falta de estudios y lineamientos sobre el rol del remplazo o reparación mitral como forma de tratamiento de las arritmias ventriculares graves . Existen descripciones anecdóticas.
7- Es imperativo un estudio prospectivo controlado de una población amplia con PVM, con detección de arritmias determinadas genéticamente, además de resonancia magnética nuclear con realce tardío con gadolinio y T1 mapping buscando las muchas piezas faltantes de este complejo, pero excepcional rompecabezas.
Bibliografía
1-Devereux RB, Jones EC, Roman MJ, Howard BV, Fabsitz RR, Liu JE, et al. Prevalence and correlates of mitral valve prolapse in a population-based sample of American Indians: the Strong Heart Study. Am J Med. 2001 Dec 15;111(9):679–85.
2-Delling Francesca N., Li Xinjun, Li Shuo, Yang Qiong, Xanthakis Vanessa, Martinsson Andreas, et al. Heritability of Mitral Regurgitation. Circ Cardiovasc Genet. 2017 Oct 1;10(5):e001736.
3-Strahan NV, Murphy EA, Fortuin NJ, Come PC, Humphries JO. Inheritance of the mitral valve prolapse syndrome: Discussion of a three-dimensional penetrance model. Am J Med. 1983 Jun 1;74(6):967–72.
4-Barlow JB, Bosman CK, Pocock WA, Marchand P. Late systolic murmurs and non-ejection (“mid-late”) systolic clicks. An analysis of 90 patients. Br Heart J. 1968 Mar;30(2):203–18.
5-Kligfield P, Levy D, Devereux RB, Savage DD. Arrhythmias and sudden death in mitral valve prolapse. Am Heart J. 1987 May;113(5):1298–307.
6-Nishimura RA, McGoon MD, Shub C, Miller FA, Ilstrup DM, Tajik AJ. Echocardiographically documented mitral-valve prolapse. Long-term follow-up of 237 patients. N Engl J Med. 1985 Nov 21;313(21):1305–9.
7-Grigioni F, Tribouilloy C, Avierinos JF, Barbieri A, Ferlito M, Trojette F, et al. Outcomes in mitral regurgitation due to flail leaflets a multicenter European study. JACC Cardiovasc Imaging. 2008 Mar;1(2):133–41.
8-Sriram CS, Syed FF, Ferguson ME, Johnson JN, Enriquez-Sarano M, Cetta F, et al. Malignant bileaflet mitral valve prolapse syndrome in patients with otherwise idiopathic out-of-hospital cardiac arrest. J Am Coll Cardiol. 2013 Jul 16;62(3):222–30.
9-Basso C, Perazzolo Marra M, Rizzo S, De Lazzari M, Giorgi B, Cipriani A, et al. Arrhythmic Mitral Valve Prolapse and Sudden Cardiac Death. Circulation. 2015 Aug 18;132(7):556–66.
10-Garbi M, Lancellotti P, Sheppard MN. Mitral valve and left ventricular features in malignant mitral valve prolapse. Open Heart. 2018;5(2):e000925.
11-Abbadi DR, Purbey R, Poornima IG. Mitral valve repair is an effective treatment for ventricular arrhythmias in mitral valve prolapse syndrome. Int J Cardiol. 2014 Nov 15;177(1):e16-18.
12-Hosseini S, Rezaei Y, Samiei N, Emkanjoo Z, Dehghani MR, Haghjoo M, et al. Effects of mitral valve repair on ventricular arrhythmia in patients with mitral valve prolapse syndrome: A report of two cases. Int J Cardiol. 2016 Nov 1;222:603–5.
13-Vaidya VR, DeSimone CV, Damle N, Naksuk N, Syed FF, Ackerman MJ, et al. Reduction in malignant ventricular arrhythmia and appropriate shocks following surgical correction of bileaflet mitral valve prolapse. J Interv Card Electrophysiol Int J Arrhythm Pacing. 2016 Aug;46(2):137–43.
14-Kitkungvan D, Nabi F, Kim RJ, Bonow RO, Khan MA, Xu J, et al. Myocardial Fibrosis in Patients With Primary Mitral Regurgitation With and Without Prolapse. J Am Coll Cardiol. 2018 Aug 21;72(8):823–34.
15-Pradella S, Grazzini G, Brandani M, Calistri L, Nardi C, Mori F, et al. Cardiac magnetic resonance in patients with mitral valve prolapse: Focus on late gadolinium enhancement and T1 mapping. Eur Radiol. 2018 Aug 7;
16-Bui AH, Roujol S, Foppa M, Kissinger KV, Goddu B, Hauser TH, et al. Diffuse myocardial fibrosis in patients with mitral valve prolapse and ventricular arrhythmia. Heart Br Card Soc. 2017;103(3):204–9.
17-Syed FF, Ackerman MJ, McLeod CJ, Kapa S, Mulpuru SK, Sriram CS, et al. Sites of Successful Ventricular Fibrillation Ablation in Bileaflet Mitral Valve Prolapse Syndrome. Circ Arrhythm Electrophysiol. 2016 May;9(5).
18-Gaita F, Giustetto C, Leclercq JF, Haissaguerre M, Riccardi R, Libero L, et al. Idiopathic verapamil-responsive left ventricular tachycardia: clinical characteristics and long-term follow-up of 33 patients. Eur Heart J. 1994 Sep;15(9):1252–60.
19-Lee A, Hamilton-Craig C, Denman R, Haqqani HM. Catheter ablation of papillary muscle arrhythmias: Implications of mitral valve prolapse and systolic dysfunction. Pacing Clin Electrophysiol. 2018 Jul;41(7):750–8.
20-Dejgaard LA, Skjølsvik ET, Lie ØH, Ribe M, Stokke MK, Hegbom F, et al. The Mitral Annulus Disjunction Arrhythmic Syndrome. J Am Coll Cardiol. 2018 Oct 2;72(14):1600–9.
21-Hourdain J, Clavel MA, Deharo J-C, Asirvatham S, Avierinos JF, Habib G, et al. Common Phenotype in Patients With Mitral Valve Prolapse Who Experienced Sudden Cardiac Death. Circulation. 2018 Sep 4;138(10):1067–9.
22-Angelini A, Ho SY, Anderson RH, Becker AE, Davies MJ. Disjunction of the mitral annulus in floppy mitral valve. N Engl J Med. 1988 Jan 21;318(3):188–9.
23-Angelini A, Ho SY, Anderson RH, Davies MJ, Becker AE. A histological study of the atrioventricular junction in hearts with normal and prolapsed leaflets of the mitral valve. Br Heart J. 1988 Jun;59(6):712–6.
24-Hong-TaoYuan null, Yang M, Zhong L, Lee Y-H, Vaidya VR, Asirvatham SJ, et al. Ventricular premature contraction associated with mitral valve prolapse. Int J Cardiol. 2016 Oct 15;221:1144–9.
25-Nordhues BD, Siontis KC, Scott CG, Nkomo VT, Ackerman MJ, Asirvatham SJ, et al. Bileaflet Mitral Valve Prolapse and Risk of Ventricular Dysrhythmias and Death. J Cardiovasc Electrophysiol. 2016 Apr;27(4):463–8.
26-Cheniti G, Vlachos K, Meo M, Puyo S, Thompson N, Denis A, et al. Mapping and Ablation of Idiopathic Ventricular Fibrillation. Front Cardiovasc Med. 2018;5:123.
27-Narayanan K, Uy-Evanado A, Teodorescu C, Reinier K, Nichols GA, Gunson K, et al. Mitral valve prolapse and sudden cardiac arrest in the community. Heart Rhythm. 2016 Feb;13(2):498–503.
28-Giudicessi JR, Rohatgi RK, Bos JM, Ackerman MJ. Prevalence and clinical phenotype of concomitant long QT syndrome and arrhythmogenic bileaflet mitral valve prolapse. Int J Cardiol. 2019 Jan 1;274:175–8.
29-Lévy S. Arrhythmias in the mitral valve prolapse syndrome: clinical significance and management. Pacing Clin Electrophysiol PACE. 1992 Jul;15(7):1080–8.
30-Veinot JP, Johnston B, Acharya V, Healey J. The spectrum of intramyocardial small vessel disease associated with sudden death. J Forensic Sci. 2002 Mar;47(2):384–8.
31-Chesler E, King RA, Edwards JE. The myxomatous mitral valve and sudden death. Circulation. 1983 Mar;67(3):632–9.
32-Le Tourneau T, Mérot J, Rimbert A, Le Scouarnec S, Probst V, Le Marec H, et al. Genetics of syndromic and non-syndromic mitral valve prolapse. Heart Br Card Soc. 2018 Jun;104(12):978–84.
33-Hofer F, Fellmann F, Schläpfer J, Michaud K. Sudden cardiac death in the young (5-39 years) in the canton of Vaud, Switzerland. BMC Cardiovasc Disord. 2014 Oct 7;14:140.
34-Winkel BG, Holst AG, Theilade J, Kristensen IB, Thomsen JL, Ottesen GL, et al. Nationwide study of sudden cardiac death in persons aged 1-35 years. Eur Heart J. 2011 Apr;32(8):983–90.
35-Zaremba T, Brøndberg AK, Jensen HK, Kim WY. Cardiac magnetic resonance characteristics in young survivors of aborted sudden cardiac death. Eur J Radiol. 2018 Aug;105:141–7.
36-Neilan TG, Farhad H, Mayrhofer T, Shah RV, Dodson JA, Abbasi SA, et al. Late gadolinium enhancement among survivors of sudden cardiac arrest. JACC Cardiovasc Imaging. 2015 Apr;8(4):414–23.
37-Rodrigues P, Joshi A, Williams H, Westwood M, Petersen SE, Zemrak F, et al. Diagnosis and Prognosis in Sudden Cardiac Arrest Survivors Without Coronary Artery Disease: Utility of a Clinical Approach Using Cardiac Magnetic Resonance Imaging. Circ Cardiovasc Imaging [Internet]. 2017 Dec [cited 2019 Jan 19];10(12). Available from: https://www.ahajournals.org/doi/10.1161/CIRCIMAGING.117.006709
38-Basso C, Marra MP, Rizzo S, De Lazzari M, Giorgi B, Cipriani A, et al. Response to Letters Regarding Article, “Arrhythmic Mitral Valve Prolapse and Sudden Cardiac Death.” Circulation. 2016 Mar 29;133(13):e460.
39-Providencia R, Lambiase PD. Letter by Providencia and Lambiase Regarding Article, “Arrhythmic Mitral Valve Prolapse and Sudden Cardiac Death.” Circulation. 2016 Mar 29;133(13):e459.
40-Narayanan K, Uy-Evanado A, Teodorescu C, Reinier K, Nichols GA, Gunson K, et al. Mitral valve prolapse and sudden cardiac arrest in the community. Heart Rhythm. 2016 Feb;13(2):498–503.
41-Missov E, Cogswell R. Sudden cardiac death, mitral valve prolapse, and long QT syndrome. Am J Med. 2015 Oct;128(10):e37-38.
42-Towbin JA. Ion Channel Dysfunction Associated With Arrhythmia, Ventricular Noncompaction, and Mitral Valve Prolapse: A New Overlapping Phenotype∗. J Am Coll Cardiol. 2014 Aug 26;64(8):768–71.
5 comments








































5 Comments
Mario Vargas
febrero 7, 2019, 10:40 pmFantástica revisión. una clase maestra
REPLYAlma Arrioja
febrero 8, 2019, 12:35 amSólo comentar que esta visión crítica entre los 2 grupos no sólo nos deja mucho académicamente hablando sino, nos hace reflexionar y re-pensar sobre la entidad principalmente en tiempos del boom como el DAM! Es una de las cosas más valiosas de sus revisiones Maestro, el pensamiento crítico que nos lleva a “aprender-desaprender-reaprender”… GRACIAS 🙏🏻
REPLYManel Acuña@Alma Arrioja
noviembre 27, 2019, 6:17 pmTe felicito mi compadre. Muy buena tu revision y comentarios. Te sugiero corregir algunos errores.
REPLYZoraima Gómez
enero 29, 2020, 1:08 amCómo siempre, excelente. Dando con tu análisis crítico un giro al aprendizaje reprogramando lo aprendido. Gracias
REPLYDaniela Diaz Capdevila
mayo 27, 2020, 6:43 amExelente clase de mi caso ….taquicardia supraventricular con prolapso de válvula mitral y riesgo de muerte súbita. Como no saber lo q se siente dia a dia tener y llevar mas ver la muerte todos los dias de mi vida ?!! Todo esta clase magistral la vivo dia a dia no me queda de otra. Gracias
REPLYA Dios le pido vivir mas