La enfermedad de Chagas se caracteriza por 3 fases: aguda, latente y crónica; la primera es una enfermedad febril autolimitada que generalmente dura de 8 a 12 semanas. A partir de entonces, los pacientes permanecen infectados crónicamente en una fase latente o indeterminada. Después de 10 a 30 años de la infección aguda, la fase
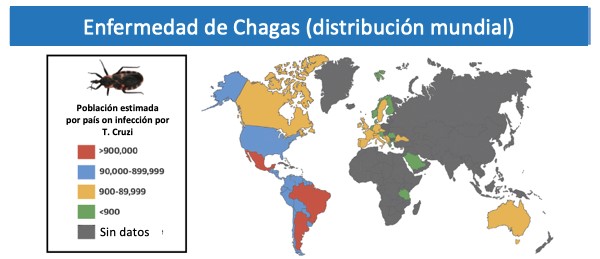
La enfermedad de Chagas se caracteriza por 3 fases: aguda, latente y crónica; la primera es una enfermedad febril autolimitada que generalmente dura de 8 a 12 semanas. A partir de entonces, los pacientes permanecen infectados crónicamente en una fase latente o indeterminada. Después de 10 a 30 años de la infección aguda, la fase crónica puede desarrollarse en 20 a 30% de los pacientes y se caracteriza por afectación de órganos, principalmente miocardiopatía o megavíscera (i.e., megaesófago, megacolon o ambos).1 La cardiomiopatía de Chagas (CC) es la complicación más frecuente y grave de esta fase. Cabe destacar que la CC tiene un mal pronóstico, con una mortalidad anual estimada del 4%, siendo la muerte súbita cardíaca (MSC) la correspondiente a la mitad de las muertes por arritmias ventriculares (AV), la principal causa.2 Aproximadamente 6 millones de personas en América Latina están infectadas por T. cruzi, con tasas de infección de hasta 6,1 casos por cada 100 habitantes en Bolivia. Las áreas rurales desfavorecidas de América Central y del Sur se han asociado tradicionalmente con la enfermedad de Chagas, sin embargo, las tendencias migratorias globales actuales han llevado a una mayor incidencia de esta condición en Europa, Asia, Australia y América del Norte.3 Bern y col. encontraron una prevalencia estimada de 300.000 inmigrantes con infección por T. cruzi en los Estados Unidos, un 10% a un 15% de ellos con características clínicas de CC.4
Histológicamente, la CC se caracteriza por infiltrados mononucleares complejos, fibrosis miocárdica y parasitismo tisular de bajo grado. Estos cambios son el resultado de una compleja relación huésped-parásito con 4 características principales: denervación autonómica cardíaca, disfunción microvascular, daño tisular inducido por parásitos, y lesión miocárdica inmunomediada.5
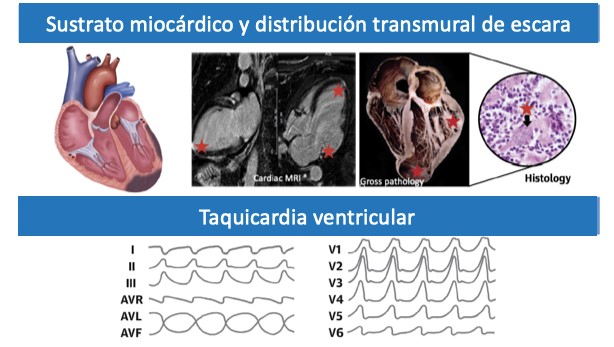
La distribución habitual de la fibrosis en CC se encuentra en las áreas inferior y lateral del ventrículo izquierdo (VI), asociada con frecuente afectación en el sistema de conducción cardíaco, lo cual la distingue de otras cardiomiopatías. Por lo tanto, las arritmias que se originan a partir de este sustrato anatómico se encuentran comúnmente en pacientes con CC y contribuyen al mal pronóstico. Las contracciones ventriculares prematuras (CVP) y la taquicardia ventricular (TV) no sostenida ocurren frecuentemente en pacientes seropositivos para la enfermedad de Chagas, y la presencia de TV no sostenida en un monitor Holter de 24 h se ha identificado como factor de riesgo de mortalidad a los 5 y 10 años de seguimiento.
A pesar de la frecuente aparición de disfunción sinusal y anomalías del sistema de conducción y la necesidad de marcapasos, cabe enfatizar que la TV se reconoce como la causa más común de síncope y MSC en pacientes con CC.2
TRATAMIENTO MÉDICO DE LA TAQUICARDIA VENTRICULARLa amiodarona se utiliza con frecuencia para el tratamiento de arritmias ventriculares en pacientes con enfermedad de Chagas. Aunque no hay ningún ensayo aleatorizado que evalúe su función, existen algunas series de casos que muestran su beneficio en la prevención de la recurrencia de la TV. Un metaanálisis de estudios observacionales no controlados demostró una reducción de TV y CVP en pacientes con CC con el uso de amiodarona, no obstante, no hubo datos disponibles sobre la reducción de la mortalidad. Aunque el uso de esta droga se asoció con microdepósitos corneales (61,1%; IC 95%: 19,0-91,3), efectos secundarios gastrointestinales y dermatológicos (16,1%; IC 95% 6,61-34,2%; y 10,6%; IC 95%: 4,77-21,9%, respectivamente) y bradicardia sinusal (12,7%; IC del 95%: 3,71-35,5%), la tasa de interrupción del fármaco fue baja (7,68%; IC del 95%: 4,17 13,7%).6
TRIPANOCIDA E INMUNOTERAPIA A la fecha, los datos sobre el uso de agentes dirigidos contra el tripanosoma en pacientes con CC no han sido alentadores. El efecto de la medicación tripanocida benznidazol se evaluó en el ensayo BENEFIT (Evaluación de Benznidazol Para Interrumpir la Tripanosomiasis). Un total de 2.584 pacientes con serología positiva para T. cruzi y cardiomiopatía establecida fueron asignados al azar a benznidazol o placebo y se les dio seguimiento durante 5,4 años con sólo el 0,5% de los pacientes perdidos durante dicho período. El estudio no mostró diferencias entre los grupos en un criterio de valoración pronóstica consistente en muerte, paro cardíaco reanimado, TV, empeoramiento de insuficiencia cardíaca, accidente cerebrovascular, tromboembolismo sistémico o pulmonar, e implantación de marcapasos o desfibrilador automático implantable (DAI).7
DESFIBRILADOR AUTOMATICO IMPLANTABLE Hay una falta de evidencia de ensayos clínicos aleatorizados que respalde el uso de DAI en CC, y los criterios de selección se basan en datos de observación y registros, así como en la extrapolación de guías de miocardiopatías de otras causas (por ejemplo, miocardiopatía isquémica [MCI]). Un estudio retrospectivo de pacientes en Brasil con DAI implantados para prevención secundaria, mostró que todos los afectados con CC desarrollaron TV recurrente a los 2 años, en comparación con el 40% de aquellos con otras miocardiopatías. Un metaanálisis reciente estimó que las tasas anuales de terapias apropiadas con DAI en pacientes con CC eran del 25% y la tasa de tormenta eléctrica fue 9,1%.8
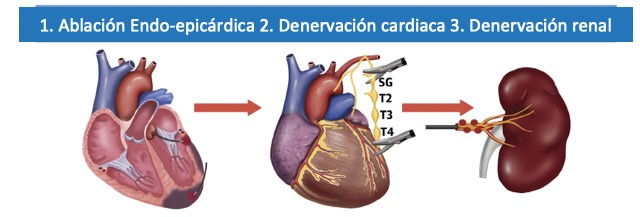
ABLACIÓN DE LA TAQUICARDIA VENTRICULAREl sustrato arritmogénico es frecuentemente intramural y el circuito es predominantemente epicárdico; en ocasiones se observan circuitos de macro-reentrada entre una cicatriz inferolateral del VI y el anillo mitral. Una gran serie de casos en Brasil estimó una prevalencia de TV epicárdica en pacientes con Chagas del 37%, que fue mayor que en pacientes con cardiomiopatía isquémica (28%) y cardiomiopatía dilatada (24%). Por lo tanto, la tasa de éxito de ablación endocárdica por radiofrecuencia de TV en CC tuvo resultados decepcionantes (17%). Recientemente, se evaluó el papel de una estrategia de ablación endocárdica/epicárdica en comparación con una estrategia endocárdica inicial. Pisani y col. asignaron al azar sujetos con CC y TV en una forma 1: 1 para el mapeo y ablación endocárdica y para el mapeo y ablación endocárdica / epicárdica combinados. La eficacia fue medida mediante la inducibilidad de TV después de la ablación y la recurrencia total de arritmias ventriculares a los 2 años de seguimiento. La seguridad se evaluó por la tasa de complicaciones periprocedimiento. Un total de 30 pacientes fueron incluidos y su mediana de edad fue de 63 años. La fracción de eyección fue 33,0 ± 9,5% para el grupo endocárdico y 35,2 ±11,5% para el grupo endocárdico/ epicárdico. El éxito inicial (no reinducibilidad de la TV clínica) se obtuvo en 6 pacientes (40%) en el grupo endocárdico solo y en 13 pacientes (86%) en el grupo endocárdico / epicárdico (p = 0,021). Hubo 12 pacientes (80%) en el grupo de endocárdico y 6 pacientes (40%) en el grupo endocárdico / epicárdico con recurrencia de TV (p = 0.02 por intención de tratar). La ablación epicárdica se realizó finalmente en 9 pacientes (60%) en el grupo endocárdico debido a la ausencia de cicatriz endocárdica o al mantenimiento de la inducibilidad de la TV. No hubo diferencias en las complicaciones entre los grupos. En consecuencia, este estudio finalmente demostró que la ablación endocárdica / epicárdica combinada con catéter de radiofrecuencia en pacientes con TV y CC aumentó significativamente la ausencia a corto y largo plazo de todas las arritmias ventriculares.9
SIMPATECTOMÍA CERVICOTORÁCICA BILATERALLos datos limitados han mostrado un rol potencial de la denervación simpática como terapia complementaria cuando la ablación de la TV está contraindicada (Ej., trombo del VI) o no fue exitosa. Una cohorte de 7 pacientes con CC con tormenta eléctrica o TV refractaria a la ablación con descargas recurrentes del DAI seguidos durante una mediana de 7 meses mostró una reducción de las descargas de una mediana de 4 (rango 2 a 30) a 0 (rango 0 a 2). Cabe destacar que el único paciente que no tuvo una ablación de TV previa, debido a trombo, fue el único que recibió una descarga en el seguimiento y luego se sometió a una ablación endocárdica / epicárdica de la TV sin recurrencia de la TV al mes de seguimiento.10
DENERVACIÓN RENALAunque inicialmente concebida para el tratamiento de la hipertensión, la denervación simpática renal ha surgido como una opción terapéutica para los pacientes con arritmias ventriculares refractarias. Armaganijan y col. realizaron un estudio de denervación renal con catéter en 10 pacientes con TV (6 con CC) refractaria al tratamiento médico o en los que no se pudo realizar la ablación por arritmias inestables o trombo del VI. En 7 pacientes, el procedimiento se realizó con un catéter de ablación cardíaca de punta irrigada. A los 6 meses de seguimiento, hubo una reducción de la carga de TV de una mediana de 28,5 episodios a 1 episodio y la estimulación antitaquicardia y las descargas del DAI se eliminaron casi por completo.11
Bibliografia
1)Bittencourt AL, Sadigursky M, Barbosa HS. [Congenital Chagas’ disease. Study of 29 cases]. Revista do Instituto de Medicina Tropical de Sao Paulo. 1975;17(3):146-159.
2)Rassi A, Jr., Rassi A, Little WC, et al. Development and validation of a risk score for predicting death in Chagas’ heart disease. The New England journal of medicine. 2006;355(8):799-808.
3)Chagas disease in Latin America: an epidemiological update based on 2010 estimates. Releve epidemiologique hebdomadaire. 2015;90(6):33-43.
4)Bern C, Montgomery SP. An estimate of the burden of Chagas disease in the United States. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2009;49(5):e52-54.
5)Marin-Neto JA, Cunha-Neto E, Maciel BC, Simoes MV. Pathogenesis of chronic Chagas heart disease. Circulation. 2007;115(9):1109-1123.
6)Moroi MK, Ruzieh M, Aboujamous NM, et al. Dataset for amiodarone adverse events compared to placebo using data from randomized controlled trials. Data Brief. 2020;28:104835.
7)Morillo CA, Marin-Neto JA, Avezum A, et al. Randomized Trial of Benznidazole for Chronic Chagas’ Cardiomyopathy. N Engl J Med. 2015;373(14):1295-1306.
8)Rassi FM, Minohara L, Rassi A, Jr., et al. Systematic Review and Meta-Analysis of Clinical Outcome After Implantable Cardioverter-Defibrillator Therapy in Patients With Chagas Heart Disease. JACC Clinical electrophysiology. 2019;5(10):1213-1223.
9)Pisani CF, Romero J, Lara S, et al. Efficacy and safety of combined endocardial/epicardial catheter ablation for ventricular tachycardia in Chagas disease: A randomized controlled study. Heart rhythm. 2020.
10)Saenz LC, Corrales FM, Bautista W, et al. Cardiac sympathetic denervation for intractable ventricular arrhythmias in Chagas disease. Heart rhythm : the official journal of the Heart Rhythm Society. 2016;13(7):1388-1394.
11)Armaganijan LV, Staico R, Moreira DA, et al. 6-Month Outcomes in Patients With Implantable Cardioverter-Defibrillators Undergoing Renal Sympathetic Denervation for the Treatment of Refractory Ventricular Arrhythmias. JACC Cardiovascular interventions. 2015;8(7):984-990.
12)Romero J, Velasco A, Pisani CF et. al. Advanced Therapies for Ventricular Arrythmias in Patients Patients with Chagasic Cardiomyopathy: State of the Art Review. JACC. 2021; 77(9):1225-42









































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados