Estamos viviendo momentos difíciles y al mismo tiempo desafiantes. Un nuevo coronavirus ha cambiado rotundamente todo el mundo, este virus denominado SARS-CoV2 (Coronavirus del síndrome respiratorio agudo severo 2) produce la enfermedad del nuevo Coronavirus 2019 (COVID-19). Esta enfermedad apareció en China en diciembre del 2019, desde entonces se ha venido transmitiendo de manera muy
Estamos viviendo momentos difíciles y al mismo tiempo desafiantes. Un nuevo coronavirus ha cambiado rotundamente todo el mundo, este virus denominado SARS-CoV2 (Coronavirus del síndrome respiratorio agudo severo 2) produce la enfermedad del nuevo Coronavirus 2019 (COVID-19). Esta enfermedad apareció en China en diciembre del 2019, desde entonces se ha venido transmitiendo de manera muy rápida, siendo declarada como pandemia el 11 de marzo del 2020 por la Organización Mundial de la Salud (OMS). Hasta la fecha el SARS-CoV2 ha infectado más de 150 millones y causado la muerte de más de 3 millones de personas en todo el mundo (https://gisanddata.maps.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6). Estados Unidos es el país más afectado, y en Latinoamérica, Brasil lidera la lista (pero también es el segundo a nivel mundial).
La enfermedad COVID-19 cursa desde casos asintomáticos o con síntomas leves (81%), casos moderados y severos (14%), hasta críticos que requieren Unidad de cuidados intensivos (5%)(1). El compromiso pulmonar es lo principal en esta enfermedad, caracterizado por daño alveolar difuso con infiltración de células inflamatorias y trombosis intravascular (2), generando desde neumonía, hasta el Síndrome de dificultad respiratorio agudo (SDRA), este último con alta tasa de mortalidad. Pero, con la experiencia de otros países, se ha ido conociendo varios aspectos fisiopatológicos de esta nueva enfermedad y que permiten un manejo más integral y promisorio. Varios estudios han determinado el compromiso de otros órganos, por mecanismos directos e indirectos. De estos, se resalta en general el mecanismo Endotelio-trombo-inflamación, que describe un daño endotelial (o disfunción endotelial), un estado de hipercoagulabilidad (protrombótico) y una respuesta inflamatoria excesiva (principalmente: tormenta de citoquinas) que causarían más daño que la ocasionada por el mismo virus (3). Este mecanismo explicaría fisiopatológicamente las complicaciones más frecuentes en COVID-19, como son: SDRA, eventos tromboembólicos venosos (micro y macro), injuria miocárdica, infarto cerebral e injuria renal aguda (3,4).
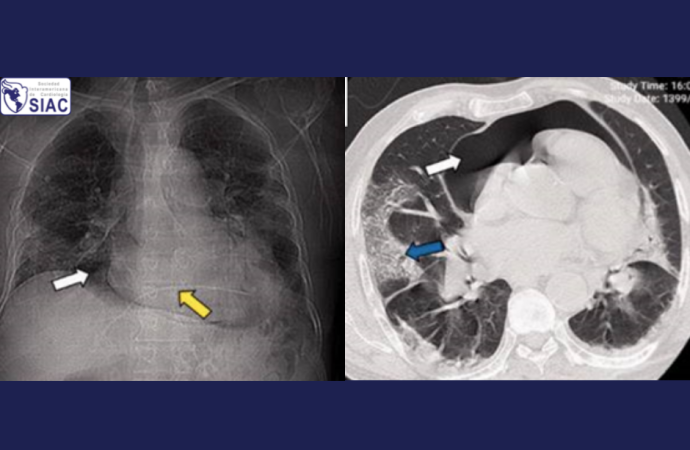
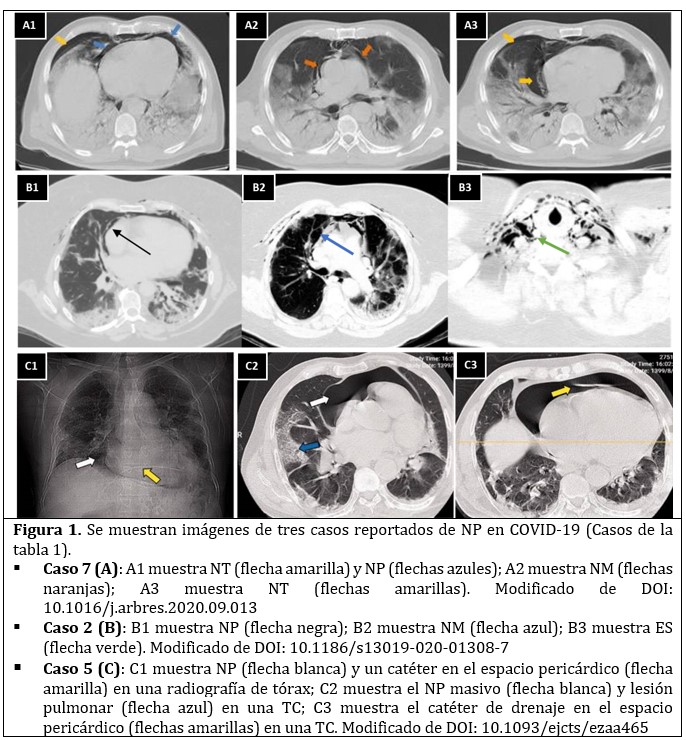
Por otro lado, se han descrito complicaciones infrecuentes relacionadas a COVID-19, como es el Neumopericardio (NP) (5–11). El NP se define por la presencia de aire en espacio pericárdico (Figura 1), y se debe resaltar, que la causa más frecuente es secundaria a procedimientos (iatrogénica) y traumatismos torácicos (abiertos o cerrados). Menos frecuente es encontrar NP espontáneo, y más raro aún, que éste se asocie a infecciones respiratorias. Su fisiopatología se relaciona íntimamente al del Neumomediastino (NM, otra complicación infrecuente de COVID-19), Neumotórax (NT) y Enfisema subcutáneo (ES). Esto se explica por el Efecto Macklin (12), demostrado en experimentos con animales, en donde se necesitan 3 mecanismos básicos para la aparición de NM/NP y otros (como NT y ES): a) incremento de la gradiente de presión entre el alveolo y el espacio intersticial perivascular, b) pérdida en la integridad de la pared alveolar (daño alveolar), y c) puertas de entrada del aire (zonas de debilidad a otros espacios o tejidos). Todo esto conlleva que el escape de aire alveolar, diseca el espacio intersticial perivascular y viaje de forma centrípeta hacia el mediastino (en primer lugar), y de aquí, pueda seguir a otros lugares como es el espacio pericardio, espacio pleural o tejido subcutáneo.
Es aceptado que el COVID-19 produce un daño alveolar importante que podría llevar a la ruptura alveolar (como principal mecanismo), con el consiguiente escape de aire. Probablemente con las nuevas cepas de SARS-CoV-2, más agresivas, estas complicaciones se podrían presentar con más frecuencia.
Para el diagnóstico de NP, se puede sospechar por la presencia del signo de “Bruit de Moulin”, considerado patognomónico, es un “soplo en rueda de molino”, un sonido cíclico a nivel precordial (9), poco frecuente; además, el dolor torácico es el síntoma más frecuente que se puede encontrar hasta en mitad de los casos. En el electrocardiograma (ECG), el NP se presenta con cambios inespecíficos, sobre todo similares a pericarditis y derrame pericárdico (bajo voltaje) (9,13). La ecocardiografía en esta oportunidad no ayuda con el diagnóstico definitivo, y permitiría, principalmente, descartar otras complicaciones relacionadas a COVID-19. Se ha descrito el “air gap sign” por ecocardiografía para la sospecha de NP/NM, que indica la presencia de ecos (actualmente definidas como líneas A) que oscurecen las estructuras de acuerdo al ciclo cardiaco en las 4 ventanas rutinariamente evaluadas (paraesternal largo, eje corto, apical 4 cámaras y subxifoidea) en el caso de NP, a diferencia del NM que no presenta dicha alteración en la ventana subxifoidea (9,14).
La radiografía de tórax nos permite el diagnóstico de NM (principalmente) y NP, aunque no puede ser posible diferenciarlos por este método cuando ambos están presentes; incluso es necesario dos proyecciones (posteroanterior y lateral izquierda) para aumentar su sensibilidad. Se describe el signo del hemidiafragma izquierdo continuo para diagnóstico de NP, que se produce por la interposición del aire entre el pericardio y la cara superior diafragmática izquierda, y se visualiza en ambas proyecciones (15). El examen por excelencia para el diagnóstico de NP, y que permite diferenciarlo fácilmente del NM, es la Tomografía computarizada (TC) torácica (9,15). Además, permite confirmar otras complicaciones relacionadas: neumotórax y enfisema subcutáneo (Figura 1), e incluso se puede observar el enfisema perivascular como hecho fisiopatológico del efecto Macklin.
Durante los meses de esta pandemia se han publicado (PubMed) hasta la fecha solo 7 artículos con el reporte de 17 casos de NP en COVID-19 (Tabla 1)(5–11). Dos de los casos fueron NP secundarios (ingresaron a ventilación mecánica antes de presentar NP), y los 15 restantes fueron NP espontáneos. Casi todos se asociaron a NM (sólo uno presentó NP aislado, muy raro), y un 35% a neumotórax y 47% a enfisema subcutáneo. El promedio de edad de los pacientes fue de 58.2 años, muy por encima de los casos reportados por otras causas, pero similar en su predilección por el sexo masculino (82% en los casos reportados). El promedio de días de hospitalización para presentar NP fue de 8.5, y la mayoría se presentó dentro de los primeros 14 días (76%). Casi la mitad (47%) de los que presentaron esta complicación tuvieron dolor torácico como síntoma. Por último, más de la mitad (53%) de pacientes con esta complicación falleció.
El tratamiento de NP en la mayoría de casos es conservador y dependerá de la severidad. En caso de ser severo y llevar a taponamiento cardiaco, requiere una intervención rápida y oportuna, mediante pericardiocentesis. En los casos reportados con COVID-19, dos presentaron un NP severo, solo en uno se realizó pericardiocentesis (Figura 1, caso C); aunque ambos fallecieron.
Por tanto, es importante tener en cuenta esta complicación en pacientes con COVID-19, principalmente en varones, dentro de las primeras 2 semanas de hospitalización y que presenten dolor torácico; y recordar que, aunque infrecuente, puede ser mortal.
Referencias bibliográficas
1.CDC Weekly C. The Epidemiological Characteristics of an Outbreak of 2019 Novel Coronavirus Diseases (COVID-19) — China, 2020. China CDC Wkly [Internet]. 2020;2(8):113–22. Available from: http://weekly.chinacdc.cn/en/article/doi/10.46234/ccdcw2020.032
2.Tian S, Xiong Y, Liu H, Niu L, Guo J, Liao M, et al. Pathological study of the 2019 novel coronavirus disease (COVID-19) through postmortem core biopsies. Mod Pathol [Internet]. 2020 Jun 14;33(6):1007–14. Available from: http://www.nature.com/articles/s41379-020-0536-x
3.Juarez-Lloclla JP. ¿Tromboprofilaxis extendida? Mecanismo Endotelio-trombo-inflamación en COVID-19 [Internet]. Sociedad interamericana de Cardiología. 2021. Available from: https://www.siacardio.com/educacion/lideres-emergentes-siac/editoriales-lideres/tromboprofilaxis-extendida/
4.Libby P, Lüscher T. COVID-19 is, in the end, an endothelial disease. Eur Heart J [Internet]. 2020 Aug 21;41(32):3038–44. Available from: https://academic.oup.com/eurheartj/article/41/32/3038/5901158
5.Sahu KK, Mishra AK, Goldman Y. A rare case of Pneumopericardium secondary to COVID-19. Hear Lung [Internet]. 2020 Nov;49(6):679–80. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0147956320303605
6.Juárez-Lloclla JP, León-Jiménez F, Urquiaga-Calderón J, Temoche-Nizama H, Bryce-Alberti M, Portmann-Baracco A, et al. Spontaneous Pneumopericardium and Pneumomediastinum in Twelve COVID-19 Patients. Arch Bronconeumol [Internet]. 2021 Jan;57(January):86–8. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0300289620303744
7.Hazariwala V, Hadid H, Kirsch D, Big C. Spontaneous pneumomediastinum, pneumopericardium, pneumothorax and subcutaneous emphysema in patients with COVID-19 pneumonia, a case report. J Cardiothorac Surg [Internet]. 2020 Dec 7;15(1):301. Available from: https://cardiothoracicsurgery.biomedcentral.com/articles/10.1186/s13019-020-01308-7
8.Scacciavillani R, Iannaccone G, Del Buono MG, Bello G. Pneumopericardium following mechanical ventilation in COVID-19 pneumonia. Papageorgiou N, Asher E, Savarese G, editors. Eur Hear J – Case Reports [Internet]. 2020 Oct 1;4(FI1):1–2. Available from: https://academic.oup.com/ehjcr/article/4/FI1/1/5893667
9.Li S, Chau E, Ghasem W, Sohn J, Yaghmour B. Air Should Not be There: A Case of Pneumomediastinum and Pneumopericardium in COVID-19. Cureus [Internet]. 2020 Nov 25;12(11). Available from: https://www.cureus.com/articles/45075-air-should-not-be-there-a-case-of-pneumomediastinum-and-pneumopericardium-in-covid-19
10.Singh A, Bass J, Lindner DH. Rare Complication of Pneumomediastinum and Pneumopericardium in a Patient with COVID-19 Pneumonia. Girgis RE, editor. Case Rep Pulmonol [Internet]. 2020 Nov 1;2020:1–4. Available from: https://www.hindawi.com/journals/cripu/2020/8845256/
11.Ghods K, Aghaamoo S, Amini Fooladi N, Zangian H. Spontaneous massive pneumopericardium in a patient with COVID-19. Eur J Cardio-Thoracic Surg [Internet]. 2020 Dec 26;00:2020. Available from: https://academic.oup.com/ejcts/advance-article/doi/10.1093/ejcts/ezaa465/6050271
12.Romero KJ, Trujillo MH. Spontaneous pneumomediastinum and subcutaneous emphysema in asthma exacerbation: The Macklin effect. Hear Lung [Internet]. 2010 Sep;39(5):444–7. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0147956309002374
13.Gan H. Pneumopericardium presenting as reduced ECG voltages. Heart [Internet]. 2005 Mar 1;91(3):298–298. Available from: https://heart.bmj.com/lookup/doi/10.1136/hrt.2004.036467
14.Md Noor J, Eddie EA. Cardiac A-lines in fast scan as a sign of pneumopericardium. Ultrasound J [Internet]. 2019;11(1):11–3. Available from: https://doi.org/10.1186/s13089-019-0123-x
15.Hamad A-MM, Elmahrouk AF, Abdulatty OA. Alveolar air leakage in COVID-19 patients: Pneumomediastinum and/or pneumopericardium. Hear Lung [Internet]. 2020 Nov;49(6):881–2. Available from: https://linkinghub.elsevier.com/retrieve/pii/S014795632030368X










































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados