Estimaciones sugieren que la población mayor a 65 años aumentará a más del doble en los próximos años, alcanzando alrededor de 1,5 mil millones de personas en 2050 (1). La fibrilación auricular (FA) es la arritmia cardíaca sostenida más común entre los pacientes adultos (2), y junto con el envejecimiento poblacional, se espera que su
Estimaciones sugieren que la población mayor a 65 años aumentará a más del doble en los próximos años, alcanzando alrededor de 1,5 mil millones de personas en 2050 (1).
La fibrilación auricular (FA) es la arritmia cardíaca sostenida más común entre los pacientes adultos (2), y junto con el envejecimiento poblacional, se espera que su prevalencia aumente 2,5 veces en los próximos 50 años, afectando para ese entonces a más de 5,6 millones de adultos solamente en la población estadounidense (3)
De la misma manera, la insuficiencia mitral (IM) moderada o severa es la enfermedad valvular más frecuente en los Estados Unidos, afectando a 2 millones de personas en 2002 (4), y estimando duplicar su prevalencia para 2030 (5).
Especialmente en pacientes con FA de larga duración o persistente, el aumento de tamaño de la aurícula izquierda (AI) podría generar dilatación del anillo de la válvula mitral y posterior IM significativa (6) aún en ausencia de agrandamiento del ventrículo izquierdo. Esta condición es conocida como insuficiencia mitral funcional auricular (IMFA) (7)
Varias publicaciones han descrito elegantemente los complejos mecanismos implicados en su instalación y perpetuación, como así también la utilidad de la ecocardiografía para una adecuada evaluación (6,7,8,9).
En este escenario, un diagnóstico preciso y temprano, así como un abordaje terapéutico correcto de esta condición serán cada vez más importantes.
Ya se ha descrito que el tamaño de la AI es un buen subrogante de las consecuencias de los diferentes grados de enfermedad valvular (10). También se ha destacado su rol pronóstico en la predicción del riesgo de aparición de FA, insuficiencia cardíaca, e incluso mortalidad (cardíaca y por todas las causas) (11). A su vez, la dilatación del anillo mitral parece ser consecuencia del agrandamiento de la AI en pacientes con FA (12).
Sin embargo, también se ha sugerido que esta dilatación anular no sería suficiente por sí sola para causar IM significativa (11,13). En pacientes con FA aislada y válvulas estructuralmente normales, la IM ha sido reportada generalmente como ausente o leve a pesar de la dilatación anular significativa (13).
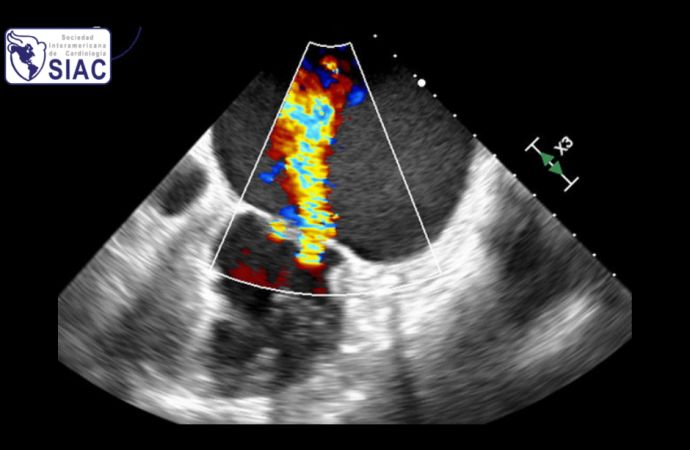
Técnicas ecocardiográficas como el speckle tracking son métodos más sensibles que las mediciones convencionales para identificar cambios tempranos en la función de AI (10) y podrían permitir la detección de enfermedad atrial subclínica.
Los pacientes con FA persistente han mostrado valores más bajos de strain de AI, en comparación con los pacientes con fibrilación auricular paroxística (14).
Esto puede sugerir que además de la dilatación del anillo mitral, un cierto grado de miopatía auricular izquierda estaría implicada (15) en el desarrollo de IMFA.
La cuantificación del tamaño y la función ventricular y auricular, el análisis de la geometría valvular y del grado de regurgitación valvular, deben realizarse inicialmente mediante ecocardiografía bidimensional (2DE) y ecocardiografía
Doppler (16, 17) aun con las limitaciones que su simple análisis implica.
Se debe tener en cuenta, que en pacientes con IMFA, los jets de IM adquieren una forma elíptica en el eje corto, resultando en una posible subestimación de la misma (18). La utilización de técnicas de ecocardiografía 3D deben considerarse para superar este tipo de obstáculos, habiéndose demostrado ventajas para la realización de un diagnóstico más preciso de la IM en comparación con ecocardiografía 2D convencional (8,9,19).
En pacientes con IMFA, Gertz et al. (20) demostró que la cardioversión y la restauración del ritmo sinusal son capaces de reducir el tamaño de la AI, así como la severidad de la IM en más del 70% de los casos (20). En otra publicación, la ablación con catéter de la FA persistente también se ha asociado con una mejoría en la insuficiencia tricuspídea y el remodelado inverso del corazón derecho (21).
Sin embargo, en la cohorte de Gertz (20), aquellos pacientes que tuvieron recurrencia de su FA posterior a la ablación, no presentaban un cambio importante en el tamaño del anillo mitral a pesar de reducciones significativas en el tamaño del AI, y más del 80% de estos pacientes todavía tenían IM significativa (7).
Todo esto podría indicar que la restauración del ritmo sinusal, si bien es necesaria, podría no ser suficiente en todos los pacientes con IFMA, e intervenciones a nivel valvular deberían ser consideradas según cada caso.
A medida que la población envejezca, los niveles de fragilidad de la misma también aumentarán, y las conductas intervencionistas mínimamente invasivas comenzarán a ser cada vez más buscadas (por ejemplo, transcatheter edge-to-edge repair, más conocido como MitraCLIP). Sin embargo, en pacientes con IMFA la dilatación severa de la AI podría limitar la efectividad de este tipo de procedimientos, de modo que la intervención quirúrgica de la válvula mitral y el procedimiento concomitante de ablación podrían considerarse (22).
Silbiger et al. Al (18) propuso varios mecanismos implicados en la IMFA, incluyendo aumento del tethering valvar, disbalance anulo-papilar, reducción de la contractilidad anular mitral y transformación endotelial-mesenquimal de las valvas mitrales.
Como ya se ha mencionado, debido a la compleja geometría, la dinámica no planar de los aparatos mitral y tricuspídeo y la multiplicidad de mecanismos involucrados, la evaluación por ecocardiografía bidimensional es insuficiente, siendo la ecocardiografía transesfoágica, y la ecocardiografía 3D esenciales para una correcta evaluación anatómica y funcional de la incompetencia valvular (6,7,23).
Al evitar presunciones geométricas por parte del observador (24), y mediante la adquisición y reconstrucción de la válvula mitral desde distintos planos, la ecocardiografía 3D permite definir con mayor precisión la extensión y localización de la patología, determinar el mecanismo implicado en la enfermedad valvular e incluso guiar procedimientos terapéuticos percutáneos en escenarios concretos (24).
Dichas conjeturas morfológicas y funcionales, no son capaces de proveer la misma cantidad ni calidad de información que una reconstrucción tridimensional. La ventaja de esta técnica se ve particularmente reflejada, por ejemplo, al momento de realizar mediciones y análisis de la vena contracta, la cuantificación del jet regurgitante y el orificio regurgitante efectivo (24).
A modo adicional, la insuficiencia tricuspídea (IT) también ha sido descripta en pacientes con IMFA, pudiendo presentar rápida progresión y posterior dilatación de cavidades derechas (22). En pacientes sometidos a intervenciones de cavidades izquierdas, la presencia de un diámetro diastólico del anillo tricuspídeo mayor a 40 mm (>21 mm/m2), desde la vista apical de cuatro cámaras, debería obligarnos a considerar la anuloplastia tricuspídea, incluso si la regurgitación es leve al momento de la cirugía (7, 22).
La evaluación anatómica de la válvula tricúspide no debe pasar desapercibida en estos pacientes, considerando que también se ha demostrado que la ecocardiografía 3D es capaz de proporcionar un análisis más preciso del aparato tricúspide en comparación con técnicas convencionales (23).
La IMFA presenta una prevalencia desconocida, un tratamiento estándar no definido, y aún mucho por descubrir. Si bien la utilidad de la ablación de la FA es indiscutible, resta por definir en que pacientes esto es suficiente y en quienes debería considerarse algún tipo de intervención a nivel valvular. La complejidad y fragilidad de los pacientes añosos obliga a debatir en profundidad cada una de las decisiones que deberemos tomar. El abordaje diagnóstico y terapéutico criterioso en forma de un Heart Team, incluyendo tecnologías y técnicas apropiadas para y garantizar el mayor beneficio al paciente, parecen ser el camino correcto ante un escenario ciertamente complejo.
REFERENCIAS
1.United Nations, Department of Economic and Social Affairs, Population Division (2019). World Population Ageing 2019: Highlights. Available at: https://www.un.org/en/development/desa/population/publications/pdf/ageing/WorldPopulationAgeing2019-Highlights.pdf
2.Benjamin, E. J., Muntner, P., Alonso, A., et al American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee (2019). Heart Disease and Stroke Statistics-2019 Update: A Report From the American Heart Association. Circulation, 139(10), e56–e528. org/10.1161/CIR.0000000000000659
3.Go, A. S., Hylek, E. M., Phillips, K. A., et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the Anticoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA. 2001; 285 (18): 2370–2375 https://doi.org/10.1001/jama.285.18.2370
4.Enriquez-Sarano M, Akins C, Vahanian A. Mitral regurgitation. The Lancet. 2009; 373 (9672): 1382-1394 org/10.1016/S0140-6736(09)60692-9
5.Nkomo, V. T., Gardin, J. M., Skelton, T. N., et. al. Burden of valvular heart diseases: a population-based study. The Lancet. 2006; 368: (9540), 1005–1011. org/10.1016/s0140-6736(06)69208-8
6.Ring, L., Dutka, D. P., Wells, F. C., Fynn, S. P., et al. Mechanisms of atrial mitral regurgitation: insights using 3D transoesophageal echo. European heart journal. Cardiovascular Imaging. 2001; 15:(5), 500–508 org/10.1093/ehjci/jet191
7.Muraru D, Andrada-Camelia G, Badano L, et al. Functional regurgitation of atrioventricular valves and atrial fibrillation: an elusive pathophysiological link deserving further attention. JASE. 2019; 33:(1); 42-53. org/10.1016/j.echo.2019.08.016
8.Ito, K., Abe, Y., Takahashi, Y., et al. Mechanism of atrial functional mitral regurgitation in patients with atrial fibrillation: A study using three-dimensional transesophageal echocardiography. Journal of cardiology. 2017; 70:(6), 584–590. https://doi.org/10.1016/j.jjcc.2017.03.013
9.Mahino-Otsuka T, Yoshihiro S, Ishizu T, et al. Novel Mechanistic Insights Into Atrial Functional Mitral Regurgitation: A 3-Dimensional Echocardiographic Study. J-Stage. 2016; 80:(10), 2240-2248 org/10.1253/circj.CJ-16-0435
10.Rosca, M., Lancellotti, P., Popescu, B. A. et al. Left atrial function: pathophysiology, echocardiographic assessment, and clinical applications. Heart British Cardiac Society. 2011; 97(23) 1982–1989 org/10.1136/heartjnl-2011-300069
11.Abhayaratna, W. P., Seward, J. B., Appleton, C. P., et al. Left atrial size: physiologic determinants and clinical applications. Journal of the American College of Cardiology. 2006; 47: (12), 2357–2363 org/10.1016/j.jacc.2006.02.048
12.Kihara, T., Gillinov, A. M., Takasaki, K., et al. Mitral regurgitation associated with mitral annular dilation in patients with lone atrial fibrillation: an echocardiographic study. Echocardiography. 2009; 26:(8), 885–889. org/10.1111/j.1540-8175.2009.00904.x
13.Otsuji, Y., Kumanohoso, T., Yoshifuku, S., et al. Isolated annular dilation does not usually cause important functional mitral regurgitation: comparison between patients with lone atrial fibrillation and those with idiopathic or ischemic cardiomyopathy. Journal of the American College of Cardiology. 2002; 39:(10), 1651–1656 org/10.1016/s0735-1097(02)01838-7
14.Kuppahally, S. S., Akoum, N., Burgon, N. S., et al. Left atrial strain and strain rate in patients with paroxysmal and persistent atrial fibrillation: relationship to left atrial structural remodeling detected by delayed-enhancement MRI. Circulation. Cardiovascular imaging. 2010; 3:(3), 231–239. org/10.1161/CIRCIMAGING.109.865683
15.Tamargo, M., Obokata, M., Reddy, Y., et al. Functional mitral regurgitation and left atrial myopathy in heart failure with preserved ejection fraction. European journal of heart failure. 2020; 22:(3), 489–498 org/10.1002/ejhf.1699
16.Lang, R. M., Badano, L. P., Mor-Avi, V., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Journal of the American Society of Echocardiography:: official publication of the American Society of Echocardiography. 2015: 28(1), 1–39.e14 org/10.1016/j.echo.2014.10.003
17.Zoghbi, W. A., Bonow, R. O.,Lang, et al. Recommendations for Noninvasive Evaluation of Native Valvular Regurgitation: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Magnetic Resonance. Journal of the American Society of Echocardiography : official publication of the American Society of Echocardiography. 2017; 30:(4), 303–371 org/10.1016/j.echo.2017.01.007
18.Silbiger J. J. Mechanistic insights into atrial functional mitral regurgitation: Far more complicated than just left atrial remodeling. Echocardiography. 2019; 36:(1), 164–169 org/10.1111/echo.14249
19.Huang, D. Q., Cui, C. Y., Zhang, J., et al. Effects of nonvalvular atrial fibrillation on the structure and function of mitral valves (a STROBE-compliant article). 2018; 97:(33), e11643 doi.org/10.1097/MD.0000000000011643
20.Gertz, Z. M., Raina, A., Saghy, L., et al. Evidence of atrial functional mitral regurgitation due to atrial fibrillation: reversal with arrhythmia control. Journal of the American College of Cardiology. 2011; 58:(14), 1474–1481 org/10.1016/j.jacc.2011.06.032
21.Itakura, K., Hidaka, T., Nakano, Y. Successful catheter ablation of persistent atrial fibrillation is associated with improvement in functional tricuspid regurgitation and right heart reverse remodeling. Heart and vessels. 2020; 35: (6), 842–851. org/10.1007/s00380-019-01546-3
22.Otto, C. M., Nishimura, R. A., Bonow, R. O. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2020; 143:(5), e35–e71 org/10.1161/CIR.0000000000000932
23.Addetia, K., Lang, R. M., & Badano, L. P. 3-Dimensional Echocardiographic Analysis of the Tricuspid Annulus Provides New Insights Into Tricuspid Valve Geometry and Dynamics. JACC. Cardiovascular imaging. 2019; 12: (3), 401–412 org/10.1016/j.jcmg.2017.08.022
24.Lang, R. M., Badano, L. P., Tsang, W., et al. European Association of Echocardiography EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiography. Journal of the American Society of Echocardiography: official publication of the American Society of Echocardiography. 2012; 25: (1), 3–46 org/10.1016/j.echo.2011.11.010









































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados