La cardiomiopatía isquémica es considerada como una disfunción del ventrículo izquierdo en presencia de enfermedad arterial coronaria grave. INTRODUCCIÓN La enfermedad isquémica cardiaca continúa siendo la causa más común de mortalidad global de acuerdo a la OMS y es la causa más común de insuficiencia cardiaca (IC) en el mundo desarrollado. El predominio de la
La cardiomiopatía isquémica es considerada como una disfunción del ventrículo izquierdo en presencia de enfermedad arterial coronaria grave.
INTRODUCCIÓN
La enfermedad isquémica cardiaca continúa siendo la causa más común de mortalidad global de acuerdo a la OMS y es la causa más común de insuficiencia cardiaca (IC) en el mundo desarrollado. El predominio de la insuficiencia cardiaca secundaria a cardiomiopatía isquémica (CMI) ha sido atribuido principalmente a los notables avances en el tratamiento de los pacientes con infarto agudo de miocardio (IAM) en la era de la trombolisis y la intervención coronaria percutánea con stents liberadores de fármaco.
Aunque no hay consenso general con respecto a la definición de CMI, esta es considerada como una disfunción del ventrículo izquierdo en presencia de enfermedad arterial coronaria grave que incluye al menos una de las siguientes características: -revascularización previa o infarto agudo de miocardio; >75% de estenosis en el tronco coronario izquierdo o en la arteria descendente anterior; dos o más vasos coronarios con >75% de estenosis luminal (1, 2).
EPIDEMIOLOGÍA
Los datos epidemiológicos muestran que el rol de la enfermedad arterial coronaria (EAC) en la IC varía de acuerdo a la región geográfica. Mientras el 10% de todos los casos de IC en África Subsahariana son atribuidos a la EAC, en Estados Unidos y Europa es tan alta como el 50% al 70%, y en América Latina y Asia el 30% a 40%. Datos provenientes de cohortes que incluyeron pacientes con IC demuestran que 2 de cada 3 pacientes se asocian a EAC obstructiva (3).
FISIOPATOLOGÍA DE LA CARDIOMIOPATÍA ISQUÉMICA
En el contexto de isquemia miocárdica incesante con deterioro del flujo sanguíneo epicárdico y/o reserva de flujo coronario, una cascada deletérea de alteraciones metabólicas, inflamatorias, neurohumorales y estructurales tendrán lugar en el miocardio del ventrículo izquierdo (VI), llevando a un remodelado adverso del mismo y eventualmente disfunción contráctil.
La transición entre la presencia de isquemia miocárdica y el desarrollo de IC es a menudo un evento abrupto relacionado con la erosión o ruptura de la placa que produce una oclusión trombótica en una arteria coronaria epicárdica. Clínicamente estos pacientes se presentan en el contexto de un síndrome coronario agudo con o sin elevación del segmento ST.
El rol de la inflamación. Después del infarto de miocardio, la aparición de isquemia miocárdica desencadena lesión celular y muerte en diferentes componentes del miocardio que incluye cardiomiocitos, células endoteliales, fibroblastos e intersticio.
Este proceso inicia una respuesta pro inflamatoria a través de una acción orquestada de varios pasos a lo largo de la cascada inmune, incluida la activación del complemento, producción de especies reactivas de oxígeno y activación de inflamasomas. La liberación de mediadores proinflamatorios induce el reclutamiento de células inflamatorias dentro de la zona de infarto y aumenta la respuesta inflamatoria después del IAM. En la zona viable del infarto, el infiltrado leucocitario puede inducir la muerte de cardiomiocitos, extendiendo así la isquemia y el remodelado miocárdico adverso más allá de la zona original de infarto.
Los modelos en ratones con infarto de miocardio muestran que los linfocitos T y B activan y modifican la lesión por isquemia-reperfusión, la cicatrización y el remodelado. Los linfocitos T CD4+ se suman a la lesión por isquemia-reperfusión inmediata, sin embargo, también son necesarios para una adecuada curación y atenuación del remodelado crónico después del infarto del miocardio. En la CMI los linfocitos T experimentan una expansión global y regulación disfuncional que expresa citokinas proinflamatorias, tienen una capacidad inmunomoduladora disminuida y presentan propiedades antiangiogénicas y fibróticas incrementadas. Las células B parecen tener efectos perjudiciales, por un lado dañan el proceso de curación y por el otro contribuyen potencialmente a la formación de autoanticuerpos en la CMI.
Disfunción coronaria microvascular. Incluso en el contexto de una revascularización miocárdica exitosa y la restauración de flujo sanguíneo epicárdico después del IAM, una considerable proporción de pacientes, casi el 50%, no logra una reperfusión miocárdica óptima. Este fenómeno conocido como no reflow es principalmente atribuido a la disfunción microvascular coronaria.
A nivel ultraestructural el periodo prolongado de isquemia seguida de reperfusión es asociada con disfunción endotelial grave, reducción de la secreción de vasodilatadores intrínsecos como óxido nítrico e incremento en la secreción de vasoconstrictores potentes como endotelina. Además, la desestabilización de las uniones celulares es asociada con incremento de la permeabilidad y edema intersticial, lo cual puede aumentar más la compresión del lecho microvascular y el tamaño del infarto. La hemorragia intramiocárdica representa la forma más severa e irreversible de lesión coronaria microvascular con destrucción de los capilares coronarios, extravasación de eritrocitos, necrosis y restos celulares dentro del núcleo del infarto.
Remodelado estructural y funcional. Los cambios neurohumorales e inflamatorios asociados con el miocardio isquémico resultan en remodelado adverso estructural y funcional de los ventrículos con fibrosis miocárdica, dilatación y disfunción sistólica.
Existen tres conceptos fisiopatológicos básicos subyacentes al miocardio isquémico del VI: miocardio aturdido, hibernado y cicatrizal.
Miocardio aturdido. Se ha descrito como un estado reversible de hipocontractilidad que persiste a pesar de la restauración de flujo sanguíneo seguido de isquemia transitoria o recurrente. Los mecanismos fisiopatológicos incluyen la depleción del ATP con reducciones en la sensibilidad al calcio y la generación de radicales libres de oxígeno, resultando en una función anormal del retículo sarcoplásmico. La recuperación de la contractilidad miocárdica ocurre dentro de los 6 meses después de la revascularización exitosa.
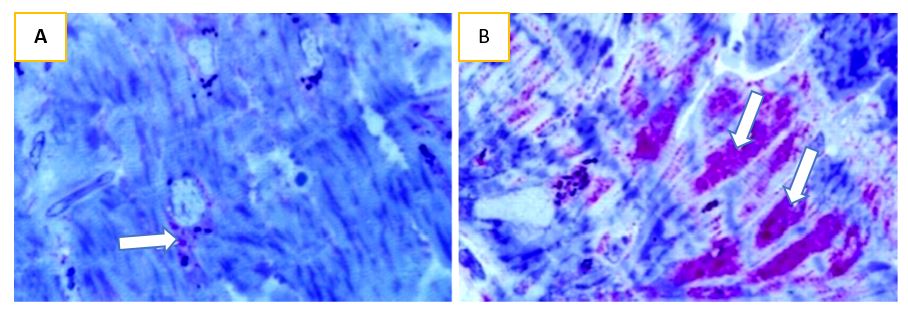
Miocardio hibernante. La hibernación produce cambios metabólicos similares al aturdimiento, pero también se acompaña de varios cambios estructurales. Un análisis celular de cardiomiocitos humanos ha mostrado pérdida completa de sarcómeras, retículo sarcoplásmico y túbulos T, con incremento en las placas de glucógeno, como se demuestra en la siguiente figura (Figura 1).
Figura 1. La tinción con ácido peryódico de Schiff (PAS), muestra pequeñas cantidades de glucógeno (flechas) alrededor de los núcleos de miocitos en el miocardio normal (A), y la acumulación intracelular de glucógeno en el miocardio en hibernación (B). (Adaptado de Briseno et al).
En el miocardio hibernante la perfusión miocárdica en reposo es adecuada para preservar la función metabólica básica. La hibernación crónica puede resultar en cambios estructurales irreversibles con desarrollo de fibrosis, expansión del espacio extracelular y formación de cicatriz miocárdica. Este miocardio hibernante podría tomar hasta un año para presentar mejoría funcional después de una revascularización exitosa.
La viabilidad es a menudo un término utilizado como equivalente de hibernación, el miocardio viable describe células que todavía están vivas con reserva contráctil, con alguna preservación de la integridad de la membrana y la actividad metabólica. Carluccio et al realizaron estudios ecocardiográficos a 42 pacientes con miocardio disfuncional en reposo programado para someterse a cirugía de revascularización coronaria, ellos encontraron que la revascularización mejora significativamente la función regional y global del VI, así como la geometría, describiendo esto como remodelado inverso. Esto es importante ya que los pacientes que tienen evidencia de miocardio viable y son llevados únicamente a tratamiento médico tienen incremento en la mortalidad. Es relevante notar que la hibernación no es una condición estable, con el número de segmentos viables disminuyendo con el tiempo en aquellos pacientes tratados médicamente.
La vía final común es el remodelado del VI, la remodelación temprana implica adelgazamiento y dilatación de la pared, con remodelado tardío irreversible como resultado de la fibrosis miocárdica y la cicatriz.
Los cambios en la forma y geometría del ventrículo son a menudo asociados con anormalidades valvulares como la insuficiencia mitral que puede acelerar aún más los cambios estructurales perjudiciales en el VI a través de la sobrecarga de volumen. La insuficiencia mitral (IM) además incrementa la presión atrial y puede resultar en hipertensión pulmonar e IC (1, 2, 3, 4, 5).
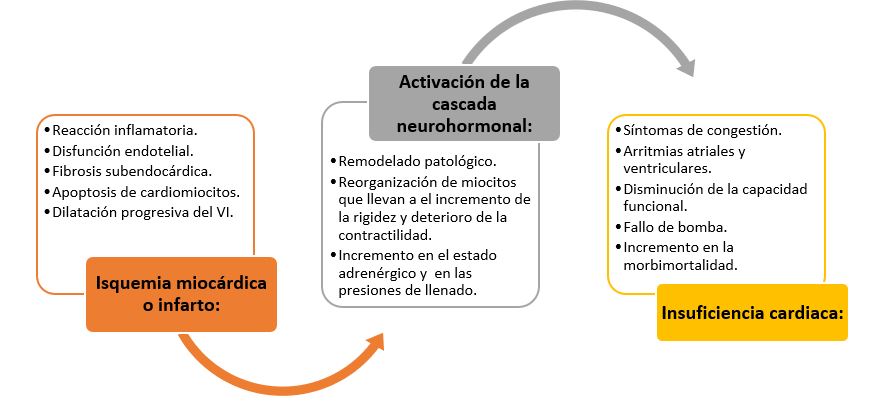
En la siguiente figura (Figura 2) se muestra en un diagrama la progresión de la enfermedad arterial coronaria a la insuficiencia cardiaca, resumiendo los puntos antes expuestos.
Figura 2. Diagrama esquemático de la progresión de la enfermedad arterial coronaria a insuficiencia cardíaca.
DIAGNÓSTICO
Imagen no invasiva y diagnóstico de miocardio viable.
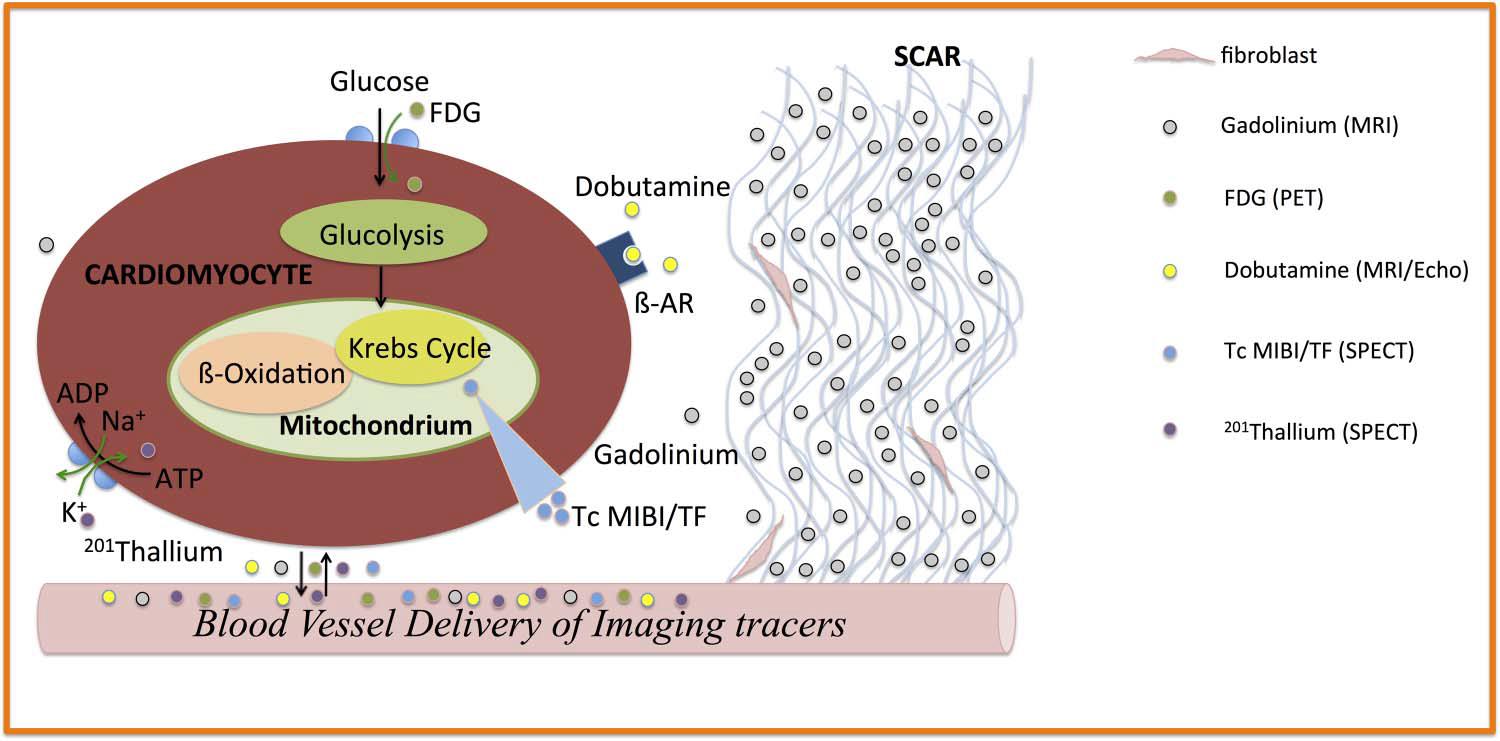
Existen varias modalidades de imagen que han sido desarrolladas para la evaluar la presencia de miocardio viable (aturdido/hibernante) o no viable (cicatrizado), su finalidad es establecer anormalidades funcionales, defectos de metabolismo/perfusión y la extensión del tejido cicatrizal. Estos test varían en sensibilidad, especificidad, limitaciones técnicas y costos, experiencia local, exactitud diagnóstica y disponibilidad, beneficiando o limitando su aplicación en la práctica clínica diaria (Figura 4).
Ecocardiografía. Es la modalidad más accesible y ampliamente disponible, representa la herramienta de primera línea para la evaluación de la viabilidad miocárdica. La dilatación severa del VI es un marcador de miocardio no viable, los índices de volumen sistólico final más altos son asociados con mala recuperación de la funcional ventricular. El grosor de la pared del VI al final de la diástole ha mostrado ser un importante predictor de miocardio viable, un grosor menor a 6 mm indica falta de reserva contráctil y recuperación funcional después de la revascularización.
Ecocardiografía de estrés. Permite la estimación del miocardio viable mediante la evaluación de la respuesta patológica al estrés después de la administración intravenosa de dobutamina en infusión. Se utiliza una dosis baja de 5-10 mcg/kg/min y una dosis alta de 10-40 mcg/kg/min. Una respuesta bifásica, es decir, incremento de la contractilidad miocárdica con bajas dosis de dobutamina y deterioro de esta con dosis altas, es altamente sugestivo de miocardio viable. Sin embargo también existen limitaciones dadas por la alta variabilidad interobservador, baja resolución espacial y ventana acústica inadecuada. Actualmente se pueden incorporar técnicas que pueden mejorar la detección de viabilidad como la ecocardiografía de contraste, Doppler tisular, strain y Eco 3D.
Tomografía computarizada por emisión de fotón único (SPECT). Es una técnica de imagen que se basa en la medición de la absorción por el miocardio de los radiotrazadores marcados que incluyen talio-201 y tecnecio-99m. Proporciona una estimación de la perfusión en reposo, isquemia inducida por el estrés, tejido cicatrizal y función sistólica cardiaca. El radiotrazador más comúnmente utilizado en la práctica clínica es el talio 201, que es absorbido activamente por los miocitos con una función de membrana preservada y por tanto refleja viabilidad miocárdica. Existen varios protocolos para establecer la viabilidad: reposo-redistribución, estrés-redistribución, estrés tardío-redistribución y estrés tardío-redistribución con reinyección. El SPECT ha mostrado una sensibilidad del 83-87% y una especificidad del 53-68% para la predicción de la recuperación regional y global contractilidad después de la revascularización exitosa.
Tomografía por emisión de positrones (PET). Es una modalidad de imagen fundamentada en el cambio de la energía de perfusión miocárdica y se basa en la identificación de una función metabólica intacta. Se realiza en dos pasos, el primero evalúa la perfusión miocárdica mediante el uso de amonio marcado con nitrógeno (13NH3) o rubidio-82 o agua marcada con oxígeno-15, el segundo paso evalúa el metabolismo de la glucosa en el miocardio, la imagen metabólica emplea 18F-fluorodesoxiglucosa (18F-FDG). El tejido viable preserva o incrementa incluso el consumo de glucosa a diferencia del no viable, metabólicamente inactivo. Un estudio de perfusión normal con captación de glucosa normal es indicativo de viabilidad. El aturdimiento miocárdico mostrará función disminuida con perfusión y metabolismo relativamente normales. El miocardio hibernante puede ser identificado por perfusión reducida con preservación o incremento del metabolismo (“mismatch” o incongruencia metabolismo-perfusión). El tejido necrótico tendrá función, perfusión y metabolismo reducidos o ausentes. El PET tiene una sensibilidad del 92% y especificidad del 63%, valor predictivo positivo y negativo de 74% y 87%, respectivamente. Las desventajas incluyen la necesidad de un ciclotrón, incremento en los costos, protocolo de estudio complejo y la dependencia de la captación de FDG.
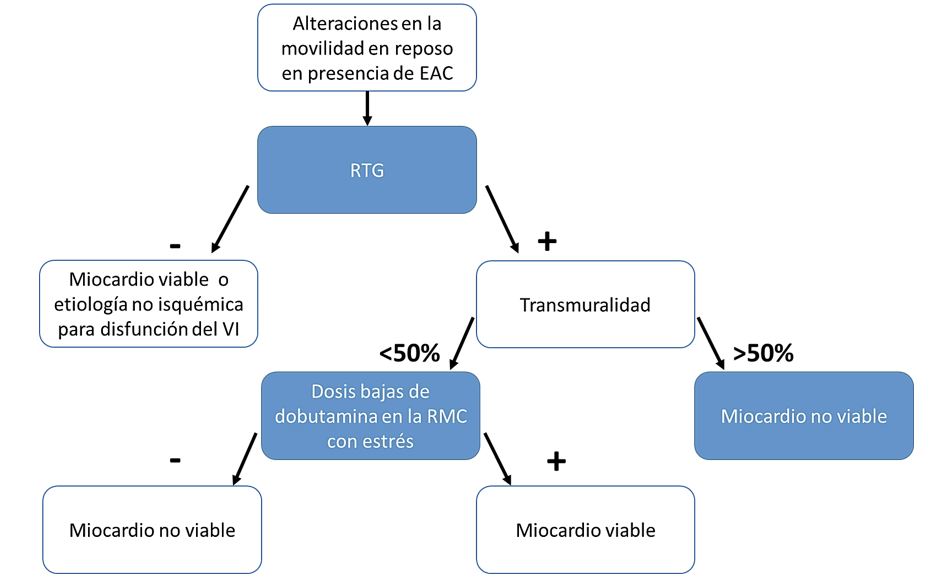
Resonancia magnética cardiaca (RMC). Esta proporciona información respecto a la estructura y función cardiaca que incluye: forma, tamaño, grosor de la pared, volumen y masas cardiacas, alteraciones en la movilidad regional y global, etc. En conjunto con el estrés con dobutamina y el realce tardío con gadolinio (RTG) puede proporcionar información respecto a la viabilidad miocárdica con reserva contráctil y la extensión del tejido miocárdico cicatrizal no viable (Figura 3). Esta modalidad de estudio es superior a otras en el establecimiento de la viabilidad miocárdica, tiene una excelente resolución espacial y también la capacidad de precisar la cantidad de tejido miocárdico no viable. Tiene una sensibilidad del 83% y especificidad del 88%. La ausencia completa de cicatriz está asociada a una recuperación de la contractilidad miocárdica aproximadamente del 78%, pero la presencia de cicatriz que excede el 50%, la recuperación funcional es del apenas el 8%. Las desventajas de esta técnica incluyen los altos costos, disponibilidad reducida, tiempos largos para la obtención de imágenes y poca cooperación del paciente para estar inmóvil y los movimientos respiratorios (1, 2, 6).
Figura 3. Se muestra el algoritmo para establecer la viabilidad miocárdica mediante RMC.
Figura 4. Objetivos fisiopatológicos de diferentes modalidades de imagen. (Adaptado de Briseno et al.)
TRATAMIENTO
Revascularización y terapia con dispositivos
El rol de la revascularización. El manejo médico óptimo ha sido establecido como la piedra angular para el tratamiento de los pacientes con IC de etiología isquémica. De acuerdo a la guía de revascularización miocárdica del 2019 de la Sociedad Española de Cardiología, la revascularización tiene una indicación clase I nivel de evidencia A para pacientes con daño en la función del VI (FEVI <35%) y enfermedad significativa de dos o tres vasos para mejorar el pronóstico (2, 7).
Dos grandes meta-análisis han demostrado un beneficio pronóstico de la revascularización en pacientes con CMI y evidencia de viabilidad comparados con los pacientes con terapia médica sola. Allman et al realizaron un meta-análisis de estudios observacionales sobre revascularización en los pacientes con disfunción del VI. Este meta-análisis incluyó 24 estudios, con un total de 3088 pacientes, estos establecían la viabilidad con PET-FDG, ecocardiograma con dobutamina e imagen de perfusión con talio, tenían una mediana de FEVI del 32 +- 8%. La mortalidad anual fue el 16% en el grupo de tratamiento médico comparado con 3.2% en el grupo de revascularización (p<0.0001). Esto representa una reducción de riesgo de alrededor del 80% para pacientes que se sometieron a revascularización por CMI que tenían viabilidad (8).
Un meta-análisis más reciente de Orlandini et al incluyó 32 estudios observacionales, encontró que los pacientes con CMI y viabilidad miocárdica tuvieron una significativa reducción en la mortalidad con revascularización comparada con la terapia medica sola, 7.3% vs 27.4% respectivamente, en un seguimiento a 28 meses (9).
Tres ensayos clínicos han examinado el rol de la revascularización en la CMI. El ensayo HEART (Heart Failure Revascularisation Trial), el PPAR-2 (Positron Emission Tomography and Recovery Following Revascularization) y el STICH (Surgical Treatment for Ischaemic Heart Failure).
El ensayo STICH es el más grande hasta la fecha, incluyó un total de 1212 pacientes que fueron seguidos a una mediana de 4.7 años, se seleccionaron aquellos individuos con CMI y FEVI <35%, la hipótesis principal fue que la revascularización asociada a la terapia médica óptima fue superior comparada con la terapia médica óptima sola, no hubo diferencias en mortalidad por todas las causas ente los dos grupos, 41% vs 36%, respectivamente. Posteriormente los resultados de seguimiento se extendieron a 10 años, en este análisis los pacientes con tratamiento médico óptimo y revascularización quirúrgica tuvieron una reducción significativa en la mortalidad por todas las causas y la mortalidad cardiovascular comparados con terapia medica óptima sola, 58.9% vs 66.1% (p=0.002) y 40.5% vs 49.3% (p=0.006), respectivamente (10).
Con esta evidencia a los pacientes con CMI y EAC significativa se les deberá ofrecer la revascularización para mejorar el pronóstico a largo plazo. Sin embargo esto no debe realizarse de forma rutinaria, se deberá individualizar el caso principalmente en aquellos pacientes con riesgo quirúrgico alto (fragilidad, ERC, enfermedades respiratorias graves, etc) .
Terapia con dispositivos. Los pacientes que extensas áreas de infarto, fibrosis y cicatrices son propensos a presentar inestabilidad eléctrica y con ello arritmias letales y muerte súbita. Los desfibriladores automáticos implantables (DAI), la terapia de resincronización cardiaca y la reparación borde a borde de la IM severa tienen un valor pronóstico aditivo en el tratamiento de estos pacientes.
El DAI puede reducir el riesgo de muerte súbita alrededor del 60-70%, sin embargo, la magnitud del beneficio se pierde con la enfermedad cardiaca avanzada y las comorbilidades asociadas.
La terapia de resincronización cardiaca puede asociarse a remodelado inverso y como consecuencia la reducción de la muerte súbita cardiaca hasta un 50% incluso en la ausencia de DAI.
La reparación percutánea borde a borde de la IM funcional con MitraClip ha mostrado ser seguro y podría conferir beneficio pronóstico debido a la mejoría de los síntomas y calidad de vida.
CONCLUSIÓN
Los pacientes con CMI requieren una evaluación adecuada, desde un pronto diagnóstico con la herramienta que esté a la mano del clínico, la instauración de una terapia médica óptima que incluya modificaciones del estilo de vida, fármacos que reduzcan la mortalidad y que modifiquen la sintomatología, el tratamiento de las comorbilidades, en caso necesario el uso de terapia con dispositivos y, finalmente, decidir por un equipo multidisciplinario (cardiólogo, electrofisiólogo, hemodinamista, cirujano cardiotorácico, rehabilitador cardiaco, etc) si el paciente es apto para tratamiento médico únicamente o si se puede realizar la vía revascularización percutánea o quirúrgica de acuerdo a los hallazgos de en los estudios de viabilidad, esto con la finalidad de mejorar el pronóstico a largo plazo en este grupo de pacientes.
Ver link AQUI
BIBLIOGRAFÍA
1.Briceno N, Schuster A, Lumley M, et al. Ischaemic cardiomyopathy: pathophysiology, assessment and the role of revascularisation. Heart 2016;0:1–10.
2.Cabac-Pogorevivi I, Muk B, Rustamova Y, et al. Ischaemic cardiomyopathy. Pathophysiological insights, diagnostic management and the roles of revascularisation and device treatment. Gaps and dilemmas in the era of advanced technology. Eur J Heart Fail 2020.
3.Elgendy I, Mahtta D, Pepine C. Medical Therapy for Heart Failure Caused by Ischemic Heart Disease. Circ Res. 2019;124:1520-1535.
4.Carluccio E, Biagioli P, Alunni G, et al. Patients with hibernating myocardium show altered left ventricular volumes and shape, which revert after revascularization: evidence that dyssynergy might directly induce cardiac remodeling. J Am Coll Cardiol 2006;47:969–77.
5.Rahimtoola S, La Canna G, Ferrari R. Hibernating myocardium: another piece of the puzzle falls into place. J Am Coll Cardiol 2006;47:978–80.
6.Mendez A, Merlano S, Murgeitio Ra, et al. Evaluación de viabilidad miocárdica por Medicinanuclear. Rev colomb Cardiol. 2019;26(S1):31-38.
7.Neumann F, Sous-Uva M, Ahlsson A, et al. Guía ESC/EACTS 2018 sobre revascularización miocárdica. Rev Esp Cardiol. 2019;72(1):73.e1-e102.
8.Allman K, Shaw L, Hachamovitch R, et al. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary artery disease and left ventricular dysfunction: a meta-analysis. J Am Coll Cardiol 2002;39:1151–1158.
9.Orlandini A, Castellana N, Pascual A, et al. Myocardial viability for decision-making concerning revascularization in patients with left ventricular dysfunction and coronary artery disease: a meta-analysis of non-randomized and randomized studies. Int J Cardiol 2015;182:494–499.
10.Velazquez E, Lee K, Jones R, et al. Coronary-artery bypass surgery in patients with ischemic cardiomyopathy. N Engl J Med 2016;374:1511–1520.









































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados