Este año hemos vivenciado el magnifico Congreso Europeo de Cardiología, realizado por la European Society of Cardiology (ESC) en conjunto con la World Heart Federation (WHF), en donde se presentaron las nuevas Guías de práctica clínica en diferentes patologías, las cuales ponen de manifiesto la necesidad de compendiar toda la evidencia científica disponible bajo una
Este año hemos vivenciado el magnifico Congreso Europeo de Cardiología, realizado por la European Society of Cardiology (ESC) en conjunto con la World Heart Federation (WHF), en donde se presentaron las nuevas Guías de práctica clínica en diferentes patologías, las cuales ponen de manifiesto la necesidad de compendiar toda la evidencia científica disponible bajo una mirada crítica y sobre todo con impacto en la práctica médica. En ese sentido, la Guía de práctica clínica de tromboembolismo pulmonar (TEP) sin duda no es la excepción.
La nueva guía de TEP busca responder algunos grandes interrogantes en torno a la estratificación de riesgo, brinda herramientas interesantes para la decisión acerca del tipo de tratamiento a instaurar tanto en internación como en forma ambulatoria, y refuerza la aplicación de tratamientos complejos como la asistencia ventricular y la reperfusión pulmonar por métodos invasivos. Intentaré en breves palabras hacer un resumen del diagnóstico y manejo del TEP agudo planteado por la guía ESC 2019.
Generalidades
El TEP representa la tercera causa de mortalidad cardiovascular después del infarto agudo de miocardio y el accidente cerebrovascular, que oscila entre el 2% y el 15 % a los 3 meses, siendo responsable de hasta 300.000 muertes anuales en Estados Unidos y en Europa. Su presentación clínica variable y frecuentemente inespecífica representa un desafío diagnóstico, con el riesgo de infraestimar su real incidencia, aumentar la morbilidad a largo plazo y por ende los costos asociados. Pese a ello, se ha detectado en los últimos años una disminución de los casos fatales, producto de la mayor adherencia a las estrategias diagnósticas y los tratamientos recomendados en las guías previas, lo que demuestra que se trata de la principal causa de mortalidad intrahospitalaria prevenible.
En este sentido, la evaluación individualizada del riesgo de trombosis venosa profunda (TVP) en pacientes internados para la prevención primaria del TEP puede justificar la aplicación de profilaxis de alto riesgo en pacientes seleccionados, aunque requiere de nuevos estudios prospectivos que validen esta conducta.
Diagnóstico
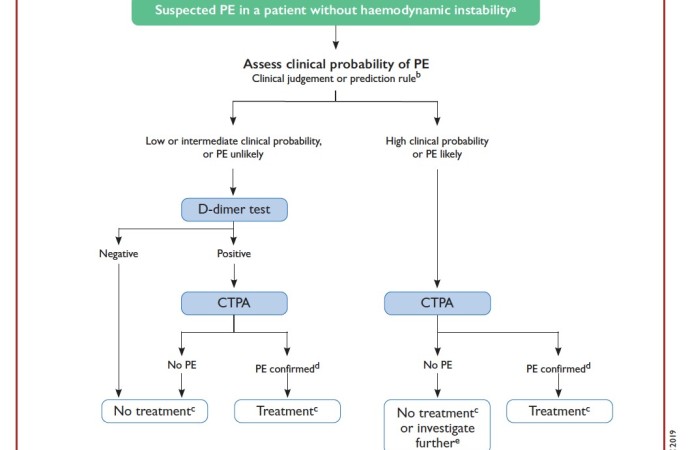
En los pacientes con bajo pretest clínico (sea por el examen físico y el interrogatorio, o bien por la utilización de escalas validadas como el puntaje de Wells y la regla de Geneva y su versión modificada) el dimero D sigue siendo de elección por su alto valor predictivo negativo (VPN) para descartar TEP, incluso en embarazadas y pacientes con cáncer (I). Un estudio multinacional ha demostrado que la especificidad del dímero D disminuye constantemente con la edad (10% en mayores de 80 años), y que el uso de límites ajustados por edad para mayores de 50 años (edad x 10 mg/L) en lugar del límite fijo “estándar” de 500 mg/L aumenta la tasa de exclusión de TEP del 6,4 al 30% sin aumentar los falsos negativos a tres meses. Por otra parte, la modificación de este límite según la presencia o no de uno o más factores de riesgo específicos (signos de TVP, hemoptisis, y TEP como diagnóstico más probable) parece también razonable (<1000 ng/mL si presenta uno o más de los anteriores), disminuyendo un 48% la utilización innecesaria de la angiotomografia pulmonar (ATCP) con respecto al uso del punto de corte fijo (recomendación IIA).
Con respecto a la ATCP, sigue considerándose el método diagnóstico de excelencia en TEP agudo por su capacidad diagnóstica y de excluir otros diagnósticos alternativos, además de su amplia disponibilidad en la actualidad y su corta duración (IA); la radiación emitida ronda los 3 a 10 mSv, por lo que deberá tenerse especial cuidado en mujeres jóvenes por la exposición del tejido mamario.
En este sentido, el SPECT V/Q aporta menor radiación (menor a 2 mSv), aunque con una capacidad diagnóstica poco validada en estudios de manejo clínico en TEP agudo (no así en crónico): de esta manera se trata de una alternativa eficaz en pacientes sin patología pulmonar estructural de base, en especial embarazadas y pacientes alérgicos al contraste iodado (IIB). En pacientes de bajo pretest clínico y sin TVP, un resultado negativo del SPECT V/Q descarta TEP (IIA). El Centellograma V/Q planar no parece util por su baja sensibilidad y especificidad, aunque su costo es claramente menor.
La angiografía pulmonar no aporta beneficio diagnóstico por sobre la ATCP, con mayor radiación y posibles complicaciones relacionadas al procedimiento.
En pacientes en los que los estudios a nivel pulmonar no son concluyentes o no puedan realizarse, si el pretest clínico es elevado la ecografía con técnica de compresión venosa de miembros inferiores puede ser una herramienta alternativa, que en caso de ser positiva (70% de TEP, con una especificidad del 96%) puede guiar el tratamiento bajo la sospecha de embolia pulmonar (IIA).
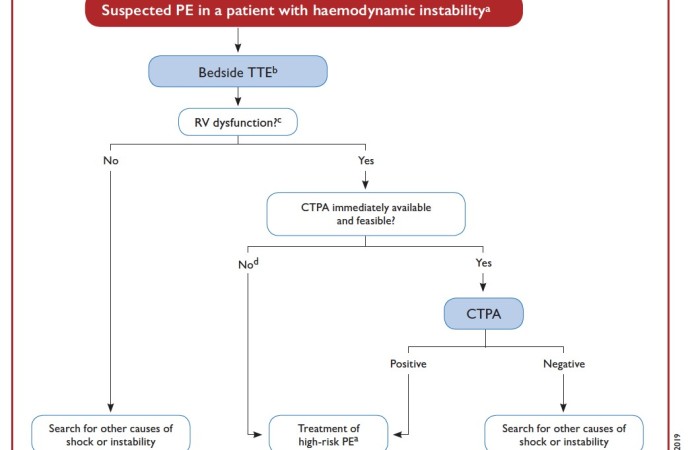
En los pacientes con descompensación hemodinámica (no trasladables a ATCP) o en aquellos en los que ésta no es concluyente, el hallazgo de dilatación o disfunción del ventrículo derecho (VD) en el ecocardiograma transtoracico (ETT) bedside indica la presencia de TEP, por lo que debe instaurarse el tratamiento adecuado (IA). Independientemente de la clínica, el hallazgo de un trombo en tránsito en cavidades derechas es diagnóstico de TEP y debe tratarse como tal (I).
La resonancia magnética no está indicada ya que no aporta mayor información a otros estudios en todos los casos (III).
Los algoritmos de diagnóstico se encuentran descriptos en la Figura 1 y Figura 2
Figura 1: algoritmo diagnóstico en TEP agudo con inestabilidad hemodinámica
Extraído de “2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism”
Figura 2: algoritmo diagnóstico en TEP agudo sin inestabilidad hemodinámica.
Extraído de “2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism”
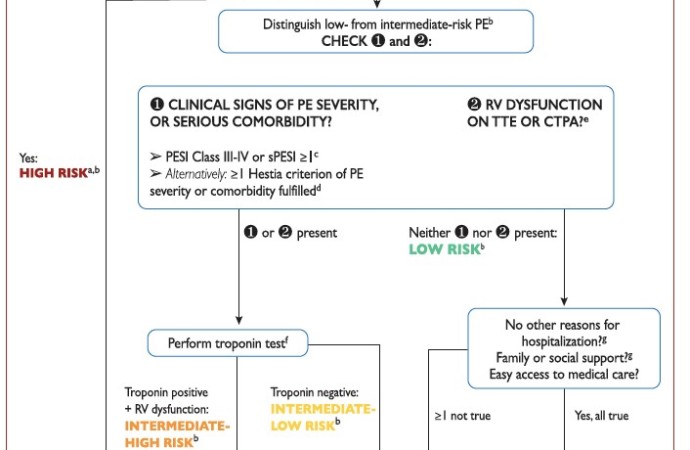
Estratificación de riesgo
Con respecto a la estratificación de riesgo, la ESC mantiene la clasificación de la guía 2014, teniendo en cuenta la evaluación de la estabilidad hemodinámica, la injuria miocárdica y la función del VD como estrategia inicial para valorar la mortalidad intrahospitalaria y a 30 días (Figura 3).
Figura 3: estratificación de riesgo en pacientes con TEP agudo.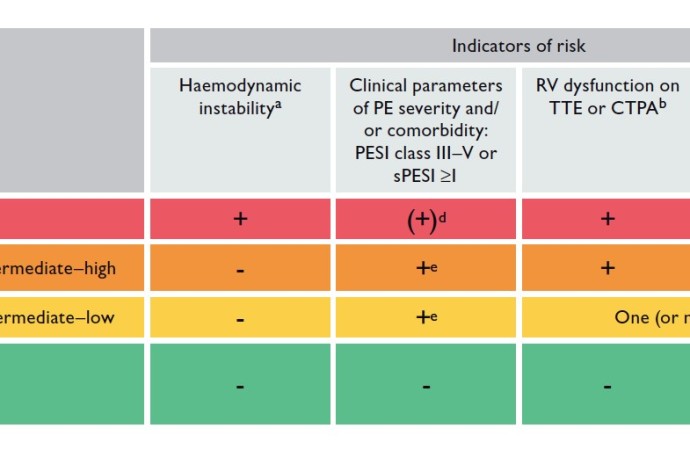
Extraido de “2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism”
Una de las grandes novedades es la nueva definición propuesta para descompensación hemodinámica: paro cardiorrespiratorio, hipotensión persistente (presión sistólica menor a 90 mmHg o disminución mayor a 40 mmHg por más de 15 min) o Shock obstructivo (hipotensión persistente asociado a uso de vasopresores y/o signos de hipoperfusión de órgano blanco). Ello ha dado más firmeza a la delimitación del TEP de alto riesgo.
En pacientes inestables, se debe efectuar un ETT para corroborar la disfunción del VD como único exámen complementario (I). En normotensos, se recomienda la utilización simultánea de puntajes validados (PESI y su versión simplificada), la valoración de la función del VD y el dosaje de marcadores de injuria miocárdica, aun cuando el puntaje calculado sea de bajo riesgo (IIA).
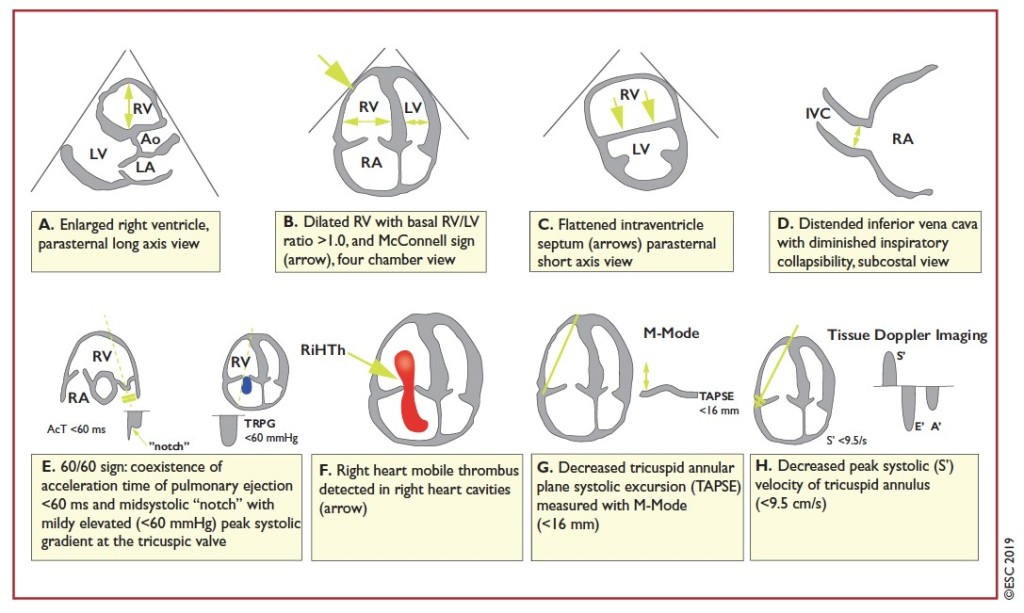
Se destaca un mejor detalle en la evaluación del compromiso del VD por embolia pulmonar en el ETT, el cual se encuentra en más del 25% de los casos. La detección de hipoquinesia o una S tisular baja de la pared libre del VD, así como la disminución de la contractilidad del ápice (signo de McConnell) sugiere TEP (12 y 20% de los pacientes no seleccionados, respectivamente), aunque puede confundirse con infarto del VD. La disminución de la excursión sistólica del plano anular tricuspideo (TAPSE) es un hallazgo sensible pero poco específico, sobre todo en pacientes con HTP previa. La combinación de un tiempo de aceleración pulmonar <60 mseg con un notch mesosistólico, asociado a un gradiente pico sistólico de la válvula tricúspide <60 mmHg (signo «60/60») presenta un elevado valor predictivo positivo (VPP), incluso en pacientes con alteraciones estructurales previas del VD o patología pulmonar de base. La presencia en el ETT o en la ATCP de un índice VD/VI mayor a 1 indica afección del VD y peor pronóstico, aunque igualmente puede hallarse en otras patologías con HTP (Figura 4).
Figura 4: alteraciones del VD en ETT en pacientes con TEP agudo
Extraido de “2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism”
La troponina ultrasensible (TUS) elevada presenta relativamente baja especificidad y VPP para mortalidad precoz en pacientes normotensos por lo que no puede utilizarse aisladamente para la toma de decisiones, aunque si cuando se interpreta en combinación con hallazgos clínicos y de imagen. Algunos estudios han demostrado asimismo la necesidad de utilizar valores de corte de TUS ajustados a la edad, aunque no puede establecerse como recomendación. Algo similar se ha demostrado con el dosaje de BNP y NT-proBNP, e incluso proponen la utilización de valores de corte mayores para aumentar la especificidad en pacientes normotensos (>600 pg/ml de NT-proBNP). Otros biomarcadores han sido evaluados con resultados positivos, aunque restan estudios para su validación definitiva: de ellos el lactato es el que más evidencia tiene a su favor a la hora de la estratificación puesto que es un marcador de hipoxia tisular y bajo gasto cardiaco. En todos los casos, la presencia de biomarcadores positivos y/o alteración de la función del VD aumenta el riesgo de muerte aun cuando los scores clínicos sean de bajo riesgo (34% de los TEP con PESI de bajo riesgo).
Por tanto, la combinación de variables clínicas a través del PESI o sPESI, con los hallazgos en el ETT y el dosaje de biomarcadores (TUS, BNP o NT-proBNP) parece ser la estrategia cualitativa más ampliamente avalada por la evidencia internacional (IIA). El score Bova y el H-FAST que combinan numéricamente dichas variables carecen actualmente de suficiente validez externa para poder ser aplicados (IIB).
Tratamiento
En cuanto al tratamiento, sabemos que la anticoagulación es el primer gesto terapéutico, incluso mientras se establece el diagnóstico en casos de riesgo intermedio o alto (I): la nueva guía europea recomienda en pacientes normotensos el uso inicial de heparinas de bajo peso molecular o fondaparinux, aunque los anticoagulantes orales directos (DOACs) han demostrado eficacia en estudios de fase III como tratamiento inicial. En los pacientes inestables hemodinámicamente se deberá utilizar preferentemente heparina endovenosa en infusión contínua ante la posibilidad de efectuar la reperfusión de urgencia (I).
El tratamiento de la hipoxemia es fundamental, resaltando los efectos deletéreos que la presión intratorácica positiva excesiva puede generar sobre el retorno venoso, en especial en caso de asistencia respiratoria mecánica. El soporte hemodinámico con ECMO o la embolectomía quirúrgica de urgencia deben considerarse en pacientes con TEP agudo con paro cardiorrespiratorio o shock refractario a precarga y fármacos vasopresores e inotrópicos (IIB), aunque la disponibilidad de estas técnicas se hallan en general en centros seleccionados de alta complejidad.
La reperfusión mediante trombolíticos sistémicos disminuye la mortalidad en TEP con descompensación hemodinámica (I): de preferencia infusiones cortas de activador tisular del plasminógeno recombinante (rTPA) a infusiones más prolongadas de estreptoquinasa o uroquinsa. No existe evidencia fuerte que sustente aún la recomendación definitiva de otros trombolíticos o del uso de dosis bajas de rTPA para reducir la tasa de sangrado. En aquellos pacientes en que la trombólisis ha fallado o esté contraindicada, la embolectomía quirúrgica de urgencia (I) o el tratamiento invasivo hemodinámico (IIA) son alternativas a considerar dependiendo las características de cada caso.
En pacientes de riesgo intermedio-alto, la utilización de terapias de reperfusión es controvertida, y naturalmente deberá balancearse el riesgo de recurrencia embólica y el hemorrágico, por lo que no se recomienda su uso rutinario (III). Aún no se han establecido recomendaciones claras acerca de qué parámetros evaluar en este subgrupo de pacientes a la hora de la toma de decisión, aunque algunas variables que demuestran incipiente inestabilidad hemodinámica pueden en conjunto ser de utilidad en este sentido (Lactato >2 mmol/l, taquicardia persistente, PAFI menor a 200, patrones electrocardiográficos de alto riesgo, entre otros).
En pacientes de riesgo bajo, el tratamiento anticoagulante podría efectuarse en forma ambulatoria, sin requerimiento de internación, siempre y cuando no existan razones médicas para su hospitalización, con un adecuado acceso al sistema de salud y contención familiar (IIA). Los DOACs en este sentido pueden facilitar la anticoagulación segura en estos casos.
Se han propuesto los criterios de Hestia (que incluyen parámetros generales de gravedad clínica en TEP, no contemplados en la clasificación standard ni en el PESI) como un punto adicional para la estratificación de riesgo en pacientes con TEP agudo, a fin de priorizar la internación si tiene uno o más de estos criterios. Sin embargo los mismos han sido diseñados originalmente con el objetivo de detectar a pacientes que pueden tener potencialmente un manejo ambulatorio seguro, por lo que serían también de utilidad en el alta temprana o el manejo ambulatorio desde el inicio.
Al igual que en guias previas, el filtro de la Vena Cava Inferior sólo se recomienda en pacientes con contraindicación para la anticoagulación o quienes tengan TEP recurrente bajo un adecuado tratamiento anticoagulante (IIA)
Se muestra el algoritmo de tratamiento propuesto de acuerdo a la estratificación de riesgo en la Figura 5.
En todos los casos, al alta institucional se recomienda anticoagulación con DOACs (edoxabán, rivaroxabán, apixabán o dabigatrán), de elección por su excelente perfil de eficacia y menor tasa de hemorragias mayores (en especial intracraneana) (I), siendo los antagonistas de la vitamina K (AVK) una alternativa si estuviesen contraindicados.
Figura 5: algoritmo de tratamiento en TEP agudo
Extraido de “2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism
Casos especiales
En pacientes con cáncer, la anticoagulación deberá ser por tiempo indefinido o hasta la curación del mismo, siendo las HBPM de elección, aunque edoxabán y rivaroxabán son igualmente eficaces y seguros en pacientes sin neoplasia gastrointestinal debido al riesgo de hemorragia con ambos DOACs (IIA).
En mujeres embarazadas, el dimero D tiene un VPN elevado, por lo que debe solicitarse para descartar TEP. El ecodoppler venoso es la herramienta diagnóstica fundamental (IIA). Eventualmente, ante ausencia de TVP y con una radiografía de torax normal podrá efectuarse un SPECT V/Q (IIA). La ATCP solo está justificada ante una radiografía de tórax patológica (IIA). El tratamiento anticoagulante permitido se basa en HBPM y heparina no fraccionada (IIA), estando contraindicados los DOACs. La reperfusión pulmonar con trombólisis sistémica o por métodos invasivos debe considerarse en TEP en este grupo de pacientes (IIA), aunque no está aconsejada en el periodo peri parto.
-
– Ver link AQUI
Conclusiones
Las nuevas guías ESC 2019 sobre diagnóstico y manejo del TEP arrojan luz en varios interrogantes que habían quedado sin respuesta clara en las guías anteriores. Sin embargo aún resta mucho trabajo por hacer para comprender completamente esta entidad y establecer recomendaciones firmes en todos los escenarios. Ello dependerá sin duda de los estudios en curso y los que se desarrollaran en el futuro: en ese camino estamos avanzando.
6 comments









































6 Comments
Eliana Lovera
abril 20, 2020, 1:30 amExcelente estudio, espero continúen realizando artículos tan explicativos y educativos como este
REPLYrolando jose hernandez romero
abril 23, 2020, 6:43 ames muy adecuado y preciso , resumen muy adecuado y útil de las guías originales.
REPLYrolando jose hernandez romero
abril 23, 2020, 6:43 ames muy adecuado y preciso , resumen muy adecuado y útil de las guías originales.
REPLYMiguel angel Reynoso velix
julio 18, 2020, 2:41 amOla buenas noches mi consulta es que tengo embolia pulmonar coágulos en los pulmones y necesito algún medicamento que me ayude a quitar este malestar y además la tos no.me deje
REPLYricardo urbina castillo
julio 25, 2020, 10:53 amMis felicitaciones excelente artículo
REPLY