Este artículo revisa la información actualizada sobre el ventrículo izquierdo no compacto. El ventrículo izquierdo no compacto (VINC) describe un fenotipo de miocardiopatía que resulta de la interacción de diferentes mecanismos genéticos y fisiopatológicos que son poco entendidos (1). Es una alteración cardiaca caracterizada por un miocardio con prominentes trabeculaciones asociadas a recesos profundos que
Este artículo revisa la información actualizada sobre el ventrículo izquierdo no compacto.
El ventrículo izquierdo no compacto (VINC) describe un fenotipo de miocardiopatía que resulta de la interacción de diferentes mecanismos genéticos y fisiopatológicos que son poco entendidos (1). Es una alteración cardiaca caracterizada por un miocardio con prominentes trabeculaciones asociadas a recesos profundos que se extienden en la cavidad ventricular hasta la superficie subendocárdica, con o sin disfunción ventricular y está asociada con un impacto variable en la morbilidad y mortalidad. Su prevalencia está estimada en 0,12 casos por 100,000 niños/año y en adultos de 0,014% al 1,3%; entre los pacientes con insuficiencia cardiaca, se ha informado una prevalencia de VINC del 3 al 4%. Sin embargo, la variación en las definiciones, criterios diagnósticos y el espectro clínico del VINC no permiten conocer su incidencia y prevalencia real (2).
Hasta ahora no es claro si el VINC es una cardiomiopatía genética distinta o es un epifenómeno o variante fenotípica de otras cardiomiopatías como la dilatada o hipertrófica. La OMS (Organización Mundial de la Salud) y la ESC (Sociedad Europea de Cardiología) consideran esta entidad como una cardiomiopatía no clasificada, sin embargo, desde el 2006 es reconocida por la AHA (Asociación Americana del Corazón) como una cardiomiopatía primaria (3). La evidencia actual apunta a una reclasificación del VINC como un fenotipo distinto, pero no siempre patológico, que resulta de la interacción genética con factores ambientales.
La genética juega un rol importante en el VINC, dado que el 17% al 50% de los pacientes tienen un miembro en la familia con cardiomiopatía; el rendimiento de las pruebas de ADN va desde 17% al 41% dependiendo de la selección del paciente y el número de genes evaluados. En la mayoría de las familias se observa un patrón de herencia autosómico dominante con penetrancia variable y la mayoría de los defectos genéticos asociados con VINC también han sido reportados en pacientes con cardiomiopatía hipertrófica y cardiomiopatía dilatada. Las mutaciones en los genes que codifican para los sarcómeros, particularmente en MYH7, TTN y MYBPC3 son las más comunes, sin embargo, el rol de los defectos genéticos del sarcómero en el desarrollo de la hipertrabeculación del miocardio no ha sido establecido aún (4).
Un estudio reciente evaluó de forma retrospectiva 327 pacientes con VINC y encontró que el riesgo de tener disfunción ventricular fue mayor para pacientes con mutaciones genéticas comparado con aquellos que no (probablemente genéticos sin mutación documentada, pero antecedente familiar de cardiomiopatía y casos esporádicos), con el riesgo más alto en aquellos con múltiples mutaciones, especialmente en TTN (Titina) (4); estos resultados ponen de manifiesto la importancia del estudio genético en las cardiomiopatías para una mejor estratificación del riesgo.
El espectro clínico es muy amplio, desde el hallazgo incidental en pacientes asintomáticos hasta aquellos con disfunción ventricular grave, eventos embólicos sistémicos y arritmias ventriculares (5). En una revisión sistemática que incluyó cinco estudios con un total de 241 pacientes adultos, el 56% tenían insuficiencia cardiaca y los síntomas más comunes fueron disnea (60%), dolor torácico (15%), palpitaciones (18%), síncope (9%) y accidente cerebrovascular (ACV) en el 3%; la tasa de eventos tromboembólicos es variable en los diferentes estudios y va desde 1% al 24% (6). La incidencia de fibrilación auricular ha sido reportada entre el 6% y el 26%, mayor al riesgo de la población general; es frecuente la presencia de arritmias supraventriculares y ventriculares con una incidencia de taquicardia ventricular (TV) sostenida que ha sido estimada del 1% al 9%, mientras que la incidencia de TV no sostenida varía del 20% al 33%; la alta incidencia de TV no sostenida está en relación directa con la presencia de disfunción ventricular; sin embargo, sigue siendo baja cuando se compara con otras formas de cardiomiopatía como la dilatada (60%) (2). El electrocardiograma suele ser anormal en el 34% de los pacientes, encontrándose bloqueo de rama, bloqueo fascicular, fibrilación auricular, bradicardia sinusal y preexcitación (18% de los pacientes pediátricos) (7).
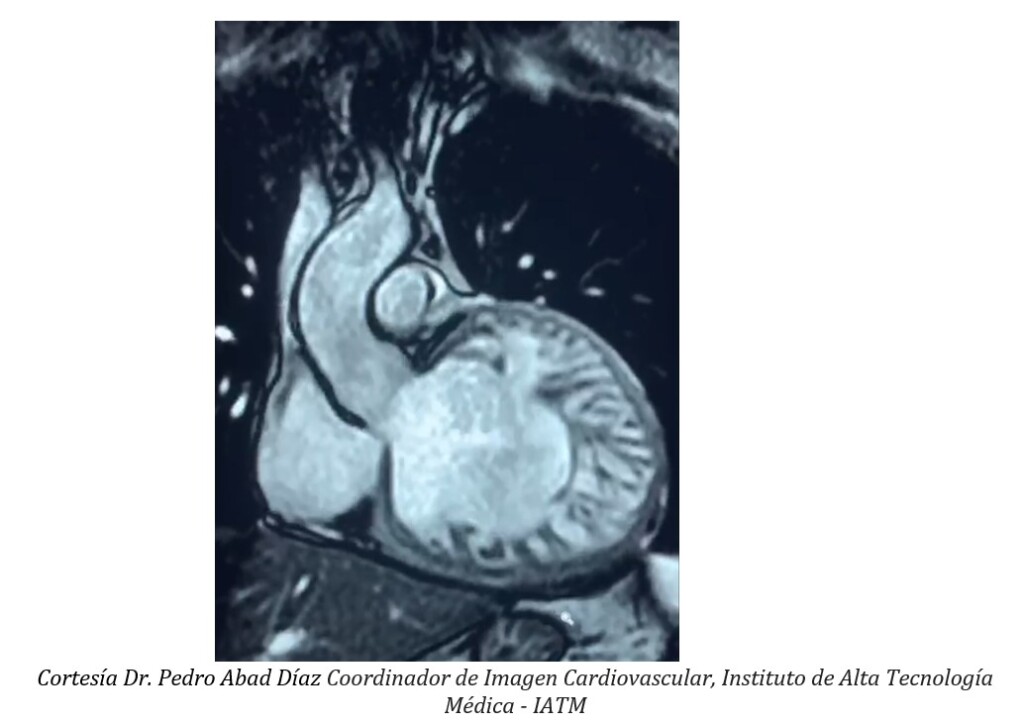
El diagnóstico de VINC se establece mediante el uso de criterios morfológicos, los cuales deben aplicarse con precaución, particularmente en individuos que carecen de otras manifestaciones clínicas de VINC, teniendo en cuenta, además, que éste puede ser un hallazgo normal y transitorio en algunas condiciones de sobrecarga de presión y volumen como el embarazo y el ejercicio de alto rendimiento (8). La ecocardiografía continúa siendo la modalidad más accesible y costo efectiva; los criterios de Jenni (9) son los más aceptados y validados, y se requiere la presencia de los siguientes hallazgos: 1) pared del ventrículo izquierdo engrosada, que consta de 2 capas, una epicárdica delgada y compactada y una endocárdica marcadamente engrosada con numerosas trabeculaciones prominentes y recesos profundos, con una relación máxima de miocardio no compactado a compactado >2:1 al final de la sístole en eje corto paraesternal; 2) evidencia por Doppler color de flujo dentro de los recesos intertrabeculares; 3) localización predominante apical y en los segmentos medioventriculares de la pared inferior y lateral; y 4) espesor de la pared compactada < 8,1 mm. Por otro lado, la resonancia cardiaca proporciona una mejor resolución y más detalles estructurales, incluida la evidencia de fibrosis que determina un valor pronóstico y de tratamiento; actualmente se recomienda el uso de resonancia, adicional a la ecocardiografía, en todos los pacientes con sospecha de VINC, usando los criterios de Petersen o Jacquier para establecer el diagnóstico (10).
Respecto al tratamiento, no existen guías clínicas específicas para el manejo del VINC y éste se basa fundamentalmente en el manejo de la disfunción cardiaca, los síntomas asociados y el riesgo embólico y de muerte súbita (11). Para pacientes asintomáticos con fracción de eyección conservada, se recomienda seguimiento clínico estrecho. En cuanto al manejo de la insuficiencia cardiaca, se recomienda seguir las guías de práctica clínica y ofrecer la terapia médica óptima actual, incluyendo terapia de resincronización y el trasplante cardiaco en los casos que lo ameriten (2,8,12).
El uso de anticoagulación para prevenir eventos embólicos en los pacientes con VINC no ha sido bien establecido y aún genera controversia; en general se recomienda en pacientes con fibrilación auricular o en aquellos con fracción de eyección <40%, complicaciones embólicas previas o evidencia de trombo ventricular (13,14). Para el manejo de las arritmias cardiacas tampoco existen recomendaciones específicas y hasta el momento se acogen las guías actuales de la práctica clínica general; como recomendación de expertos se sugiere realizar estudio electrofisiológico en todo paciente con VINC y arritmias sintomáticas o síncope. El implante de un cardiodesfibrilador dependerá de la presencia de síncope cardiogénico, arritmias ventriculares sintomáticas, disfunción sistólica severa del ventrículo izquierdo o antecedentes familiares de muerte súbita (12,13,15) .
El pronóstico es altamente variable y depende de la gravedad de presentación clínica, la disfunción ventricular, clase funcional, la presencia de fibrosis en la resonancia y la asociación con mutaciones genéticas, principalmente de TTN (8).
Autoras:
Clara Inés Saldarriaga
Cardióloga, especialista en falla cardiaca, Clínica CardioVID. Jefe del posgrado de cardiología de la Universidad Pontificia Bolivariana y docente de la Universidad de Antioquia. Medellín, Colombia.
Kelly Betancur Salazar
Residente cardiología Universidad Pontificia Bolivariana – Clínica CardioVID. Medellín, Colombia
BIBLIOGRAFÍA
1.Arbustini E, Weidemann F, Hall JL. Left ventricular noncompaction: A distinct cardiomyopathy or a trait shared by different cardiac diseases? J Am Coll Cardiol. 2014;64(17):1840–50.
2.Wengrofsky P, Armenia C, Oleszak F, Kupferstein E, Rednam C, Mitre CA, et al. Left Ventricular Trabeculation and Noncompaction Cardiomyopathy: A Review. EC Clin Exp Anat. 2019 Aug;2(6):267–83.
3.Maron BJ, Towbin JA, Thiene G, Antzelevitch C, Corrado D, Arnett D, et al. Contemporary Definitions and Classification of the Cardiomyopathies. Circulation. 2006 Apr 11;113(14):1807–16.
4.van Waning JI, Caliskan K, Hoedemaekers YM, van Spaendonck-Zwarts KY, Baas AF, Boekholdt SM, et al. Genetics, Clinical Features, and Long-Term Outcome of Noncompaction Cardiomyopathy. J Am Coll Cardiol. 2018;71(7):711–22.
5.Londo A, Abad P, Delgado J, Restrepo-carvajal S. Cardiología. 2016;23(3).
6.Bhatia NL, Tajik AJ, Wilansky S, Steidley DE, Mookadam F. Isolated Noncompaction of the Left Ventricular Myocardium in Adults: A Systematic Overview. J Card Fail. 2011 Sep;17(9):771–8.
7.Rao K, Bhaskaran A, Choudhary P, Tan TC. The role of multimodality imaging in the diagnosis of left ventricular noncompaction. Eur J Clin Invest. 2020 Sep 14;50(9).
8.Vergani V, Lazzeroni D, Peretto G. Bridging the gap between hypertrabeculation phenotype, noncompaction phenotype and left ventricular noncompaction cardiomyopathy. J Cardiovasc Med. 2020 Mar;21(3):192–9.
9.Jenni R. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy. Heart. 2001 Dec 1;86(6):666–71.
10.Dreisbach JG, Mathur S, Houbois CP, Oechslin E, Ross H, Hanneman K, et al. Cardiovascular magnetic resonance based diagnosis of left ventricular non-compaction cardiomyopathy: impact of cine bSSFP strain analysis. J Cardiovasc Magn Reson. 2020 Dec 30;22(1):9.
11.Oechslin E, Jenni R. Left Ventricular Noncompaction. J Am Coll Cardiol. 2018 Feb;71(7):723–6.
12.Dorantes Sánchez M, Jerez A, Hechavarría Poymiró S. Ventrículo izquierdo no compacto: panorámica y arritmogenia. CorSalud. 2018;10(1):52–67.
13.Oechslin E, Jenni R. Left ventricular non-compaction revisited: a distinct phenotype with genetic heterogeneity? Eur Heart J. 2011 Jun 2;32(12):1446–56.
14.Kido K, Guglin M. Anticoagulation Therapy in Specific Cardiomyopathies: Isolated Left Ventricular Noncompaction and Peripartum Cardiomyopathy. J Cardiovasc Pharmacol Ther. 2019 Jan 18;24(1):31–6.
15.Miyake CY, Kim JJ. Arrhythmias in Left Ventricular Noncompaction. Card Electrophysiol Clin. 2015 Jun;7(2):319–30.
5 comments








































5 Comments
Ender Salto
octubre 7, 2020, 11:44 amSaludos
REPLYEnder Salto
octubre 7, 2020, 11:44 amSaludos
REPLYAlejandro Aristizabal
octubre 7, 2020, 1:01 pm¡Excelente! Explica lo necesario y con gran calidad, esto hace que sea facil de entender y tener una teoría clara respecto a la enfermedad
REPLYEsleni rios
marzo 1, 2022, 1:37 amSoy diagnosticada con ventrículo izquierdo no compactado hace 12 años y soy operada del corazón hace 20 pero nunca más me a visto un cardiólogo puedo tener un riesgo alto de muerte suvita
REPLYDR Manuel Barrera
abril 2, 2022, 9:33 pmCualquier seria el tratamiento actual para el MIocardio no compacto?
REPLY