Esta editorial analiza el artículo recientemente publicado por Gregory Piazza en JACC sobre los avances en el tratamiento del tromboembolismo de pulmón de riesgo intermedio. El tromboembolismo de pulmón (TEP) es la tercera causa de mortalidad cardiovascular en los pacientes hospitalizados. En EE. UU, se estima que 100.000 a 180.000 personas mueren anualmente por TEP
Esta editorial analiza el artículo recientemente publicado por Gregory Piazza en JACC sobre los avances en el tratamiento del tromboembolismo de pulmón de riesgo intermedio.
El tromboembolismo de pulmón (TEP) es la tercera causa de mortalidad cardiovascular en los pacientes hospitalizados.
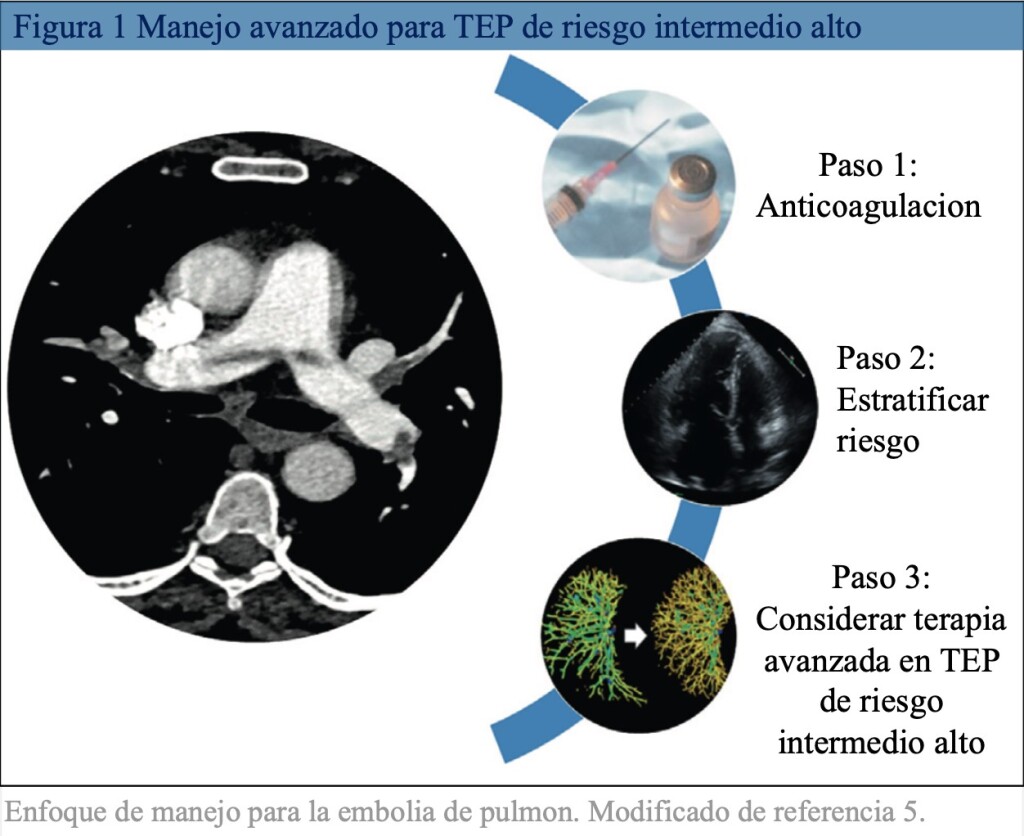
En EE. UU, se estima que 100.000 a 180.000 personas mueren anualmente por TEP (1-3). Dentro de su espectro de presentación clínica, el TEP de riesgo intermedio presenta una mortalidad a corto plazo del 3-15% por lo cual representa un desafío importante a la hora de definir un correcto enfoque terapéutico (figura 1), ya que un subgrupo de pacientes, normotensos con evidencia de disfunción del ventrículo derecho y biomarcadores elevados, llamados de “riesgo intermedio alto” o submasivos para la literatura americana, evolucionaran con falla ventricular derecha progresiva, shock cardiogénico y/o muerte súbita. Por esto, es importante una correcta estratificación inicial, el inicio temprano de la anticoagulación y un monitoreo continuo para la detección precoz del deterioro hemodinámico para así evaluar el riesgo/beneficio de una eventual terapia de reperfusión de rescate. En respuesta al desafío clínico actual que representa el TEP, han surgido equipos multidisciplinarios llamados equipos de respuesta en embolia de pulmón (PERT) integrados por cardiólogos, neumólogos, intensivistas, hematólogos y especialistas en imágenes con el objetivo de individualizar la atención y reducir la heterogeneidad del manejo avanzado en el TEP, aunque en la actualidad están ganando una amplia aceptación y demostrando un gran potencial, queda pendiente su evaluación para comprender mejor sus beneficios y costos.
Cuando hacemos mención del manejo avanzado del TEP, nos referimos a la trombolisis sistémica, a las intervenciones basadas en catéteres, a la embolectomía quirúrgica y al soporte circulatorio o asistencia ventricular derecha.
La trombolisis puede ser sistémica (más común) o local (directamente en la arteria pulmonar), con estreptoquinasa o trombolíticos fibrinoespecíficos. El estudio PEITHOS (4) publicado en el año 2014 comparó dos estrategias en pacientes con TEP de riesgo intermedio alto, una basada en trombolíticos sistémicos con Tenecteplase más anticoagulación vs anticoagulación sola. El estudio evidenció disminución del endpoint primario (mortalidad por todas las causas y colapso hemodinámico a los 7 días) a favor de la estrategia con trombolíticos, a expensas de una disminución del colapso hemodinámico, por otro lado, aumentó de manera significativa la tasa de sangrado mayor, con un 2% de sangrado intracraneal en la rama del Tenecteplase. El seguimiento a 3 años tampoco mostró beneficio a favor de la estrategia con Tenecteplase (5). Teniendo en cuenta estos resultados, el beneficio de la trombolisis sistémica en el TEP de riesgo intermedio alto sería solo para un pequeño subgrupo de pacientes que se encuentran en un estado de “pre-shock” o que no presentan mejoría clínica después de un periodo de tiempo de anticoagulación.
Por esto y con el objetivo de disminuir la tasa de sangrado sin perder eficacia, se desarrollaron las terapias con catéter, en la actualidad contamos con:
-Fibrinólisis directa con catéter
-Terapia fármaco-mecánica
-Embolectomía con catéter
La fibrinólisis directa con catéter se refiere a la administración del trombolítico directamente en la arteria pulmonar, con el objetivo de conseguir una mayor efectividad y una menor tasa de sangrado debido a que se administra una menor dosis a través de catéteres multiperforados. Si bien la dosis continúa siendo activamente investigada, los diversos estudios han utilizado entre 20-24 mg de Alteplase. Los catéteres que habitualmente se usan son el Uni-Fuse y Cragg-McNamara, ambos cuentan con la aprobación de la FDA para la infusión en la vasculatura periférica sin una indicación específica en TEP.
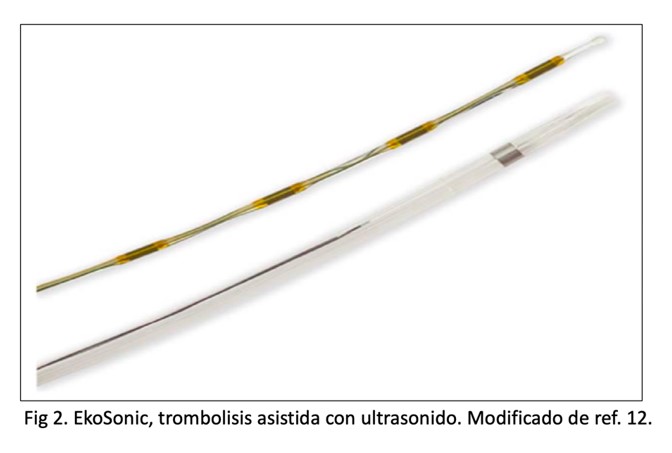
En la actualidad la terapia fármaco-mecánica, ha cobrado un especial interés, debido a que la trombectomía permite la disrupción de los puentes de fibrina del trombo por lo que el trombolítico utilizado localmente tiene la potencial ventaja de incrementar la eficacia de la disolución del trombo por el efecto sinérgico de una mayor concentración local del trombolítico con una mayor exposición del área de superficie del trombo. Pero lo más importante de esto, es que se puede usar una dosis menor de líticos con un potencial menor riesgo de sangrado. Desde el punto de vista técnico, contamos con dos tipos de dispositivos que se dividen según usen o no asistencia con ultrasonido, estos últimos son en la actualidad los que cuentan con más evidencia para su uso en TEP. El EkoSonic endovascular system (figura 2) incorpora en el catéter múltiples pequeños transductores de ultrasonido cuya función es facilitar la llegada del trombolítico (rt-PA) al interior del trombo, ya que la energía del ultrasonido altera la arquitectura del coágulo al disociar los puentes de fibrina y aumentar los sitios de unión para el trombolítico, y a la vez permite utilizar menores dosis de rt-PA minimizando el riesgo de sangrado. En cuanto a la evidencia, el estudio más importante es el SEATTLE II (6), multicéntrico y no controlado, que contó con 150 pacientes de los cuales el 75% eran de riesgo intermedio. Con este dispositivo se demostró disminución significativa de la relación VD/VI y de las presiones pulmonares, a costa de una tasa de sangrado mayor del 10% sin hemorragia intracraneal. Como desventaja, su alto costo y la ausencia de evidencia comparando cabeza a cabeza la terapia fármaco-mecánica con la trombolisis sistémica o local.
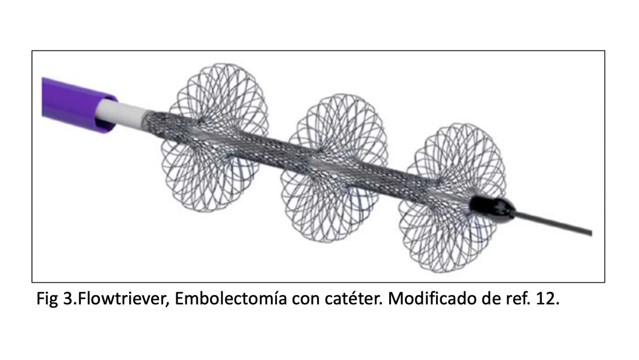
La embolectomía con catéter se refiere a una terapia no lítica, no quirúrgica que busca a través de diversos dispositivos remover el trombo y aliviar la obstrucción en la arteria pulmonar. El candidato ideal, es el paciente con descompensación hemodinámica con contraindicación para trombolíticos o refractariedad a los mismos, con trombos centrales, lobares o interlobares, ya que los más distales son más difíciles de alcanzar debido a la restricción anatómica impuesta por la vasculatura. Entre los dispositivos, contamos con el FlowTriever (figura 3), que combina el uso de un catéter con discos de nitinol autoexpandibles para producir la maceración del trombo y con otro catéter de 20 french para la aspiración de los trombos liberados. El estudio FLARE (7), multicéntrico y no controlado, demostró en 106 pacientes con TEP de riesgo intermedio disminuir la relación VD/VI con respecto al basal, sin sangrados mayores, pero con una tasa no despreciable de deterioro clínico. Esto último enfatiza la compensación entre trombolisis con catéter y embolectomía con catéter, sangrado en un lado y riesgo de descompensación clínico-hemodinámica por el otro.
Otros dispositivos, el AngioVac y sistema Indigo, técnicamente similares al FlowTriever, todavía no cuentan con ensayos clínicos randomizados que apoyen su uso en el TEP.
Si bien la evidencia actual es escasa, pero en crecimiento, se espera que estos dispositivos cobren mayor relevancia con el devenir de nuevos estudios que certifiquen su eficacia con una esperada baja tasa de complicaciones y aún mejor, que puedan ser comparados cabeza a cabeza con las terapias con trombolíticos.
Los dispositivos de soporte circulatorio mecánico temporal tienen un rol en el tratamiento del paciente con TEP de alto riesgo como puente a alguna estrategia de reperfusión o con shock cardiogénico refractario. En el 2015 el Impella RP se convirtió en el primer dispositivo de soporte circulatorio percutáneo para el ventrículo derecho en ser aprobado por la FDA. El Impella RP suministra sangre desde el área de entrada que se encuentra en la vena cava inferior hasta el área de salida en la arteria pulmonar, de esta manera bypasea el ventrículo derecho, siendo capaz de conseguir un aumento del gasto cardiaco de hasta 4 l/min. Consideraciones importantes a tener en cuenta son que sólo brinda apoyo circulatorio por lo que pacientes con hipoxemia no serían candidatos adecuados, por otro lado, a la hora de su implante se deberá evaluar la anatomía pulmonar debido a que la trombosis pulmonar concomitante puede conllevar un aumento mayor de las resistencias y empeorar la disfunción del ventrículo derecho. Por último, en la actualidad no contamos con evidencia para apoyar el uso de este dispositivo en el TEP de alto riesgo (8).
Si bien la evidencia es escasa basada en reporte y serie de casos, el ECMO veno arterial impresiona ser el método de elección ya que aporta tanto un soporte respiratorio como hemodinámico que puede exceder los 5 litros por minuto (9). En general, la canulación se realiza a través de la vena y arteria femoral de manera percutánea, si se requiere una mayor descompresión del ventrículo derecho se puede proceder a una canulación a través de la vena yugular interna. Con esto, se bypasea la circulación pulmonar y se descarga el ventrículo derecho y se devuelve la sangre oxigenada por la cánula arterial. Al momento de considerar el ECMO o cualquier método de asistencia, el beneficio debe ser contrabalanceado con el riesgo de complicaciones vasculares mayores y sangrados, sobre todo cuando se decide la colocación en estos escenarios de emergencia. Entre ellas, la más temible es la isquemia de miembro inferior la cual puede prevenirse colocando una cánula de menor tamaño en la femoral superficial para asegurar la perfusión de dicho miembro.
A pesar de todo lo previamente descrito, hay datos que sugieren que los TEP de alto riesgo no son adecuadamente tratados, teniendo en cuenta que el 5% se presentan al momento de la consulta con hipotensión arterial. A pesar de esto, solo una minoría recibe tratamiento con fibrinolíticos sistémicos o terapias a través de catéteres (10,11). Las razones para esto no están del todo claras, probablemente estén relacionadas con los riesgos percibidos asociados con estas terapias invasivas y novedosas y, por otro lado, la ausencia de evidencia de calidad que evalúe eficacia y seguridad juega un rol importante a la hora de toma de decisiones. En este contexto, los equipos de respuesta en embolia de pulmón (PERT), se crearon como en otras áreas de la cardiología con el objetivo de abordar de manera multidisciplinaria estas brechas en el conocimiento. Este enfoque asegura que médicos con diferentes perspectivas sobre diversos enfoques terapéuticos participen en la decisión de tratamiento.
Puntos principales:
-El TEP debe ser temprana y correctamente estratificado. Para esto, debemos realizar una correcta valoración clínica incluyendo los scores, medir biomarcadores y realizar ecocardiograma para valorar función del ventrículo derecho.
-Sólo un subgrupo de los pacientes catalogados como TEP de riesgo intermedio alto se beneficiará de una terapia de reperfusión. Es importante el monitoreo y seguimiento de estos pacientes para detectar de manera precoz el deterioro clínico-hemodinámico, ya que esto conlleva mayor mortalidad intrahospitalaria.
-En la actualidad contamos con numerosos métodos para la reperfusión. Si bien es un área con un notable desarrollo, queda pendiente la realización de ensayos clínicos aleatorizados con la potencia adecuada para poder definir el lugar que ocupan las diversas terapias con catéteres para la reperfusión en el TEP de riesgo intermedio alto.
-Los fibrinolíticos específicos sistémicos cuentan con la mayor cantidad de evidencia en la actualidad. Ante la posibilidad de su administración debe siempre valorarse el riesgo/beneficio, ya que conllevan un riesgo no despreciable de sangrado mayor y hemorragia intracraneal.
-Los dispositivos de apoyo circulatorio mecánico, mayormente el ECMO, quedan reservados solo para los pacientes con shock cardiogénico para una estabilización inicial como puente a una terapia de reperfusión o los que se encuentran en shock refractario con dosis altas de inotrópicos y vasopresores.
Ver link AQUI
Referencias bibliográficas:








































2 Comments
Wences Apaza Mamani
abril 7, 2021, 12:49 pmSerá de mucho provecho
REPLYNancy Alessandrini
abril 19, 2021, 9:27 pmExcelente ilustración!
REPLY