Mecanismo endotelio-trombo-inflamación en COVID-19 Desde el inicio de esta nueva enfermedad en Wuhan, China, en diciembre del 2019, y la progresión a estado de pandemia (11 de marzo del 2020), la enfermedad por coronavirus 2019 (COVID-19) se convirtió en una prioridad para la comunidad científica: en esclarecer su historia natural, su fisiopatología y el manejo
Mecanismo endotelio-trombo-inflamación en COVID-19
Desde el inicio de esta nueva enfermedad en Wuhan, China, en diciembre del 2019, y la progresión a estado de pandemia (11 de marzo del 2020), la enfermedad por coronavirus 2019 (COVID-19) se convirtió en una prioridad para la comunidad científica: en esclarecer su historia natural, su fisiopatología y el manejo más adecuado.
De las características de este Coronavirus del síndrome respiratorio agudo severo 2 (SARS-CoV-2) causante de COVID-19, resalta su alta tasa de contagiosidad, que se presenta, incluso, en asintomáticos. Afecta predominantemente el sistema respiratorio, pero con diversas complicaciones en otros sistemas. Resaltando su alta tasa de eventos trombóticos: una prevalencia de lesiones microtrombóticas pulmonares en pacientes críticos, 2 veces más alta que en pacientes críticos por otras enfermedades (1).
En más de 12 meses de enfermedad, muchos tratamientos propuestos al inicio, fueron relegándose a la luz de ensayos clínicos que demostraban su ineficacia. Pero, ha quedado bien establecido, que el tratamiento inmunomodulador con corticoide juega un papel importante en la recuperación de pacientes con COVID-19, y que también podría serlo el tratamiento anticoagulante. Por un lado, un reporte preliminar del estudio RECOVERY(2), un ensayo clínico con 6425 pacientes, demostró que el uso de Dexametasona 6mg (oral o intravenosa) por 10 días, disminuye la mortalidad a los 28 días, en pacientes que necesitaron oxígeno suplementario (intubados o no); además un metanálisis (de 07 ensayos clínicos, incluyendo RECOVERY) concluye también que el uso de corticoides (también: Hidrocortisona y Metilprednisolona) reduce mortalidad en estos pacientes. Y por el otro lado, Nadkarni et al (3) en un estudio retrospectivo de 4389 pacientes, observó que el uso de anticoagulación profiláctica o terapéutica se asoció a menor mortalidad hospitalaria, e intubación. A esto, sumamos información publicada últimamente (notas de prensa) sobre tres importantes ensayos clínicos (REMAP-CAP, ACTIV-4 y ATTACC) que buscan definir relación entre dosis de anticoagulantes y su beneficio en la mortalidad: en diciembre del 2020 se detuvo el reclutamiento de pacientes críticos con COVID-19 (que requieren UCI) debido a que no se observó beneficio, y hasta pudo ser perjudicial con dosis plenas de anticoagulación con heparinas (4); y en enero del 2021 informan una reducción de la necesidad de soporte vital (como ventilación mecánica) y tendencia en reducción de mortalidad en pacientes COVID-19 moderados hospitalizados (no críticos), con el uso de anticoagulación plena (HBPM o HNF) a comparación de dosis profiláctica(5). Sin embargo, se espera próximamente los reportes completos de estos ensayos clínicos.
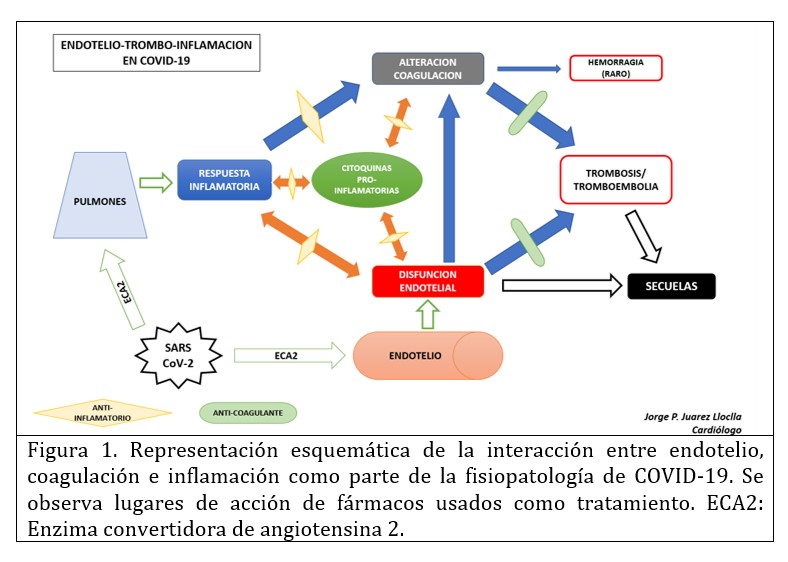
La base fisiopatológica, que explica estos beneficios terapéuticos, se observa en la figura 1. Existe una interrelación entre la respuesta inflamatoria y de la coagulación, siendo esta última capaz, de activar e intensificar la inflamación (6–8). Esto último, se ha denominado tromboinflamación. Se agrega también la disfunción endotelial que se genera por daño directo por el SARS-CoV-2 (mediado por ECA2), y que explicaría el daño observado a nivel microcirculatorio (microtrombosis pulmonar)(8). Todo esto inicia con la respuesta sistémica inflamatoria al daño pulmonar, que puede llegar hasta una tormenta de citoquinas (principalmente: interleuquina-1, interleuquina-6 y Factor de necrosis tumoral alfa), que, sumado a la injuria endotelial, promueven un estado protrombótico: aumento del factor tisular, activación del sistema de complemento, activación plaquetaria y reducción de anticoagulantes naturales (antitrombina III, inhibidor del factor tisular y proteína C)(7,8). Por tanto, se estaría presentando un mecanismo de Endotelio-trombo-inflamación como parte importante en la fisiopatología de COVID-19. Adicionalmente, se ha encontrado que la respuesta inmunológica innata mediada por neutrófilos juega un papel importante para el desarrollo de enfermedad más severas. Tanto por mecanismos directos (infección por SARS-CoV-2) como indirectos (mediados por complemento y plaquetas activadas) los neutrófilos producen niveles elevados de Trampas Extracelulares (compuestos de cromatina, proteínas microbicidas y enzimas oxidantes para contener infecciones) (9,10), los cuales potencian la activación Endotelio-trombo-inflamación, con el consecuente mayor daño y riesgo de complicaciones.
Este mecanismo Endotelio-trombo-inflamación puede permanecer por varias semanas, incluso sin presencia del SARS-CoV-2. Todo esto hace posible que en la fase de convalecencia (después del alta hospitalaria), los pacientes mantienen el riesgo de trombosis microvascular y/o macrovascular (eventos tromboembólicos); aumentando este riesgo, la actividad física que será limitada, tanto por la secuela pulmonar (disnea), como por el aislamiento que aún mantenemos en varios países (inamovilidad), completando la clásica triada de Virchow: estado de hipercoagulabilidad, injuria endotelial y estasis venosa, que favorece la formación de trombos.
Ante estos hechos, se ha propuesto la llamada Tromboprofilaxis extendida para pacientes con COVID-19 después del alta hospitalaria(11,12), tratando de prevenir complicaciones y disminuir secuelas (al limitar el daño pulmonar por la microtrombosis residual que podría permanecer en estos pacientes). Algunos autores lo sugieren por un tiempo entre 7 a 14 días, pero otros proponen extender hasta 35 a 42 días usando anticoagulantes orales directos (ACOD). Esto último, apoyado en estudios previos con pacientes no COVID-19: con Apixaban (2.5mg 2 veces/día) en el 2011(13), con Rivaroxabán (10mg 1 vez/día) en el 2013 (MAGELLAN)(14) y con Betrixaban (80mg 1 vez/día) en el 2016 (APEX)(15). No obstante, existen otros ACOD (Dabigatrán y Edoxabán) que, en base a su farmacodinámica y a la fisiopatología antes descrita, podrían considerarse para esta estrategia, pero que tampoco tienen estudios en COVID-19 que demuestren su beneficio en este contexto. Además, en diferentes consensos y algoritmos propuestos, se ha sugerido como anticoagulante de elección a la heparina no fraccionada o de bajo peso molecular, y suspender o evitar el uso de los ACOD, en pacientes hospitalizados por COVID-19 (fase aguda); principalmente por la interacción con varios de los fármacos de acción antiviral (12), pero que actualmente, la mayoría no se usa.
Por tanto, la Tromboprofilaxis extendida para COVID-19 usando ACOD (que tienen eficacia y seguridad probada en otras patologías), es una estrategia muy interesante que responde a la fisiopatología de esta nueva enfermedad, a sus complicaciones y secuelas cardiopulmonares; pero que necesita de estudios clínicos aleatorizados para poder conocer su verdadero impacto clínico y potencial beneficio (que aún no conocemos).
Referencias bibliográficas
1.Carfora V, Spiniello G, Ricciolino R, Di Mauro M, Migliaccio MG, Mottola FF, et al. Anticoagulant treatment in COVID-19: a narrative review. J Thromb Thrombolysis [Internet]. 2020 Aug 18;(0123456789). Available from: http://link.springer.com/10.1007/s11239-020-02242-0
2.Dexamethasone in Hospitalized Patients with Covid-19 — Preliminary Report. N Engl J Med [Internet]. 2020 Jul 17;NEJMoa2021436. Available from: http://www.nejm.org/doi/10.1056/NEJMoa2021436
3.Nadkarni GN, Lala A, Bagiella E, Chang HL, Moreno P, Pujadas E, et al. Anticoagulation, Mortality, Bleeding and Pathology Among Patients Hospitalized with COVID-19: A Single Health System Study. J Am Coll Cardiol [Internet]. 2020 Aug 26;27631. Available from: http://www.onlinejacc.org/content/early/2020/08/24/j.jacc.2020.08.041.abstract
4.National Institutes of Health (NIH). NIH ACTIV Trial of blood thinners pauses enrollment of critically ill COVID-19 patients [Internet]. News Realeases. 2020 [cited 2021 Jan 31]. Available from: https://www.nih.gov/news-events/news-releases/nih-activ-trial-blood-thinners-pauses-enrollment-critically-ill-covid-19-patients
5.National Institutes of Health (NIH). Full-dose blood thinners decreased need for life support and improved outcome in hospitalized COVID-19 patients [Internet]. News Realeases. 2021 [cited 2021 Jan 31]. Available from: https://www.nih.gov/news-events/news-releases/full-dose-blood-thinners-decreased-need-life-support-improved-outcome-hospitalized-covid-19-patients
6.Paar V, Wernly B, Zhou Z, Motloch LJ, Hoppe UC, Egle A, et al. Anti-coagulation for COVID-19 treatment: both anti-thrombotic and anti-inflammatory? J Thromb Thrombolysis [Internet]. 2020;(0123456789). Available from: https://doi.org/10.1007/s11239-020-02212-6
7.Kasinathan G, Sathar J. Haematological manifestations, mechanisms of thrombosis and anti-coagulation in COVID-19 disease: A review. Ann Med Surg [Internet]. 2020;56(June):173–7. Available from: https://doi.org/10.1016/j.amsu.2020.06.035
8.Connors JM, Levy JH. COVID-19 and its implications for thrombosis and anticoagulation. Blood [Internet]. 2020 Jun 4;135(23):2033–40. Available from: https://ashpublications.org/blood/article/135/23/2033/454646/COVID19-and-its-implications-for-thrombosis-and
9.Skendros P, Mitsios A, Chrysanthopoulou A, Mastellos DC, Metallidis S, Rafailidis P, et al. Complement and tissue factor-enriched neutrophil extracellular traps are key drivers in COVID-19 immunothrombosis. medRxiv [Internet]. 2020;130(11):6151–7. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7598040/pdf/jci-130-141374.pdf
10.Veras FP, Pontelli M, Silva C, Toller-Kawahisa J, de Lima M, Nascimento D, et al. SARS-CoV-2 triggered neutrophil extracellular traps (NETs) mediate COVID-19 pathology. medRxiv [Internet]. 2020;217(12). Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7488868/pdf/JEM_20201129.pdf
11.Moores LK, Tritschler T, Brosnahan S, Carrier M, Collen JF, Doerschug K, et al. Prevention, Diagnosis, and Treatment of VTE in Patients With Coronavirus Disease 2019: CHEST Guideline and Expert Panel Report. Chest [Internet]. 2020;158(3):1143–63. Available from: https://doi.org/10.1016/j.chest.2020.05.559
12.Costa A, Weinstein ES, Sahoo DR, Thompson SC, Faccincani R, Ragazzoni L. How to Build the Plane While Flying: VTE/PE Thromboprophylaxis Clinical Guidelines for COVID-19 Patients. Disaster Med Public Health Prep [Internet]. 2020 Jun 16;1–15. Available from: https://www.cambridge.org/core/product/identifier/S1935789320001950/type/journal_article
13.Yang ZYM, Mao C, Tang JL. Apixaban versus Enoxaparin in Medically Ill Patients. N Engl J Med [Internet]. 2012 Feb 23;366(8):767–8. Available from: http://www.nejm.org/doi/abs/10.1056/NEJMc1200176
14.Cohen AT, Spiro TE, Büller HR, Haskell L, Hu D, Hull R, et al. Rivaroxaban for Thromboprophylaxis in Acutely Ill Medical Patients. N Engl J Med [Internet]. 2013 Feb 7;368(6):513–23. Available from: http://www.nejm.org/doi/10.1056/NEJMoa1111096
15.Cohen AT, Harrington RA, Goldhaber SZ, Hull RD, Wiens BL, Gold A, et al. Extended Thromboprophylaxis with Betrixaban in Acutely Ill Medical Patients. N Engl J Med [Internet]. 2016 Aug 11;375(6):534–44. Available from: http://www.nejm.org/doi/10.1056/NEJMoa1601747








































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados