Señoras y señores: Este grupo farmacológico ha llegado para quedarse en la terapéutica cardiovascular. Las gliflozinas, también conocidas como inhibidores del cotransporte sodio glucosa renal tipo 2 (i-SGLT2). En estas líneas revisaremos la historia del desarrollo de estos fármacos como antidiabéticos y el giro inesperado que los posicionó como fármacos cardiovasculares. ¿Qué es el SGLT2?
Señoras y señores: Este grupo farmacológico ha llegado para quedarse en la terapéutica cardiovascular. Las gliflozinas, también conocidas como inhibidores del cotransporte sodio glucosa renal tipo 2 (i-SGLT2). En estas líneas revisaremos la historia del desarrollo de estos fármacos como antidiabéticos y el giro inesperado que los posicionó como fármacos cardiovasculares.
¿Qué es el SGLT2?
En sujetos sanos, fisiológicamente se filtran en condiciones basales hasta 180 gramos diarios de glucosa a través de los capilares glomerulares, pero se reabsorben totalmente a nivel tubular, y dicho valor se relaciona con glucemias de 180 mg/dL (dintel renal de la glucemia), el cual puede oscilar entre 130 y 300 mg/dL dependiendo de la edad, diabetes, y otros factores. Los cotransportadores de sodio y glucosa SGLTs se encuentran en la membrana luminal de las células tubulares. La sodio potasio ATPasa de la cara basolateral genera un gradiente químico y eléctrico que favorece el ingreso de sodio por difusión pasiva, y esto facilita el ingreso de glucosa, que luego atraviesa la membrana basolateral hacia el intersticio mediante los transportadores constitutivos GLUT2.
El SGLT2 se encuentra expresado en el segmento S1 del túbulo contorneado proximal, es de baja afinidad pero alta capacidad, y es el responsable de la reabsorción de casi toda la glucosa filtrada. Por otro lado, el SGLT1 se expresa en el segmento S3 del mismo túbulo, es de alta afinidad pero baja capacidad.
La reabsorción de la glucosa desde la luz tubular hacia el intersticio renal se produce entonces en forma dependiente de sodio, principalmente a nivel del túbulo contorneado proximal (SGLT2) y en menor medida a través del SGLT1 expresado en la parte distal del túbulo contorneado proximal. Si se satura el umbral de transporte de glucosa de estas moléculas (con valores aproximadamente de 180 mg/dL de glucemia en humanos), la glucosa excedente se eliminará por orina. Los antagonistas SGLT2, por lo tanto, llevan a un incremento en la eliminación de glucosa al bloquear su reabsorción (y consecuentemente… de sodio) (1-6).
¿Cómo fue el desarrollo de los i-SGLT2?
En los estudios iniciales, la florizina se utilizó como antagonista directo de todos los SGLT. Con el tiempo, se han desarrollado inhibidores del SGLT2 (i-SGLT2), de administración oral y que bloquean completamente al SGLT2 en forma selectiva, o a SGLT1 y 2. Al inhibir la reabsorción de glucosa y sodio en el túbulo contorneado proximal, se provoca glucosuria, diuresis osmótica, y natriuresis. Ello lleva a una reducción en la glucemia, pero también en la precarga y la postcarga, bloqueo del sistema renina angiotensina aldosterona, y en la liberación de prostaglandinas. Los fármacos desarrollados son Canagliflozina, Dapagliflozina, Empagliflozina, Ipragliflozina, Luseogliflozina, Sotagliflozina, y Tofogliflozina. De ellos, Canagliflozina, Ipragliflozina, y Sotagliflozina son inhibidores tanto de SGLT1 como SGLT2. Estos fármacos son de administración oral, con un pico plasmático entre los 30 minutos y las 2 hs según la molécula, y una cinética de eliminación tiempo dependiente con una vida media en plasma que oscila entre 9 y 16 hs (las vidas medias de las drogas son, en orden descendente: canagliflozina > dapagliflozina > ipragliflozina > empagliflozina > tofogliflozina > luseogliflozina), lo que permite una posología de una toma diaria en la mayoría de los casos. La excreción urinaria de glucosa se incrementó con todos los fármacos en forma dosis-dependiente, así como la reducción en la glucemia y la insulinemia (1-6).
Estudio EMPAREG-Outcomes, un antes y un después
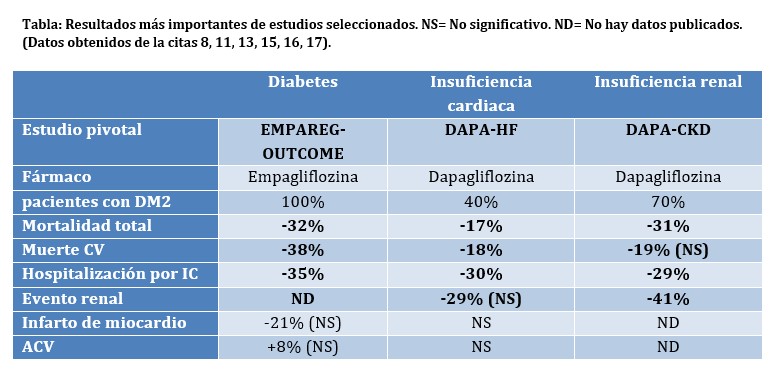
Desde el pedido de la FDA acerca del desarrollo de fármacos antidiabéticos para reducir eventos cardiovasculares (CV), el primer gran ensayo clínico en demostrarlo fue EMPAREG-Outcomes (7), donde se observó aproximadamente un tercio de reducción de hospitalizaciones por insuficiencia cardiaca, mortalidad CV, así como mortalidad total (ver tabla).
Ya en Septiembre 2017, quien escribe había indicado la importancia del cardiólogo en la toma de decisiones en la elección de fármacos antidiabéticos (8).
Efecto de clase, metanálisis
Los demás fármacos que finalizaron grandes ensayos clínicos en fase 3 de desenlaces cardiovasculares (canagliflozina en CANVAS, y dapagliflozina en DECLARE-TIMI-58) presentaron similar tasa de reducción de eventos. Sin embargo, para la mayoría de las gliflozinas, existe una diferencia en los resultados en eventos de insuficiencia cardiaca en comparación con eventos vasculares (IAM, ACV, EVP y amputaciones). Quizás sea este el talón de Aquiles de los i-SGLT2, y un terreno a llenar por los GLP-1rA, con un mayor impacto en la reducción de eventos vasculares. Ello se ve reflejado en las normativas de diabetes más recientes (ADA 2021) (9).
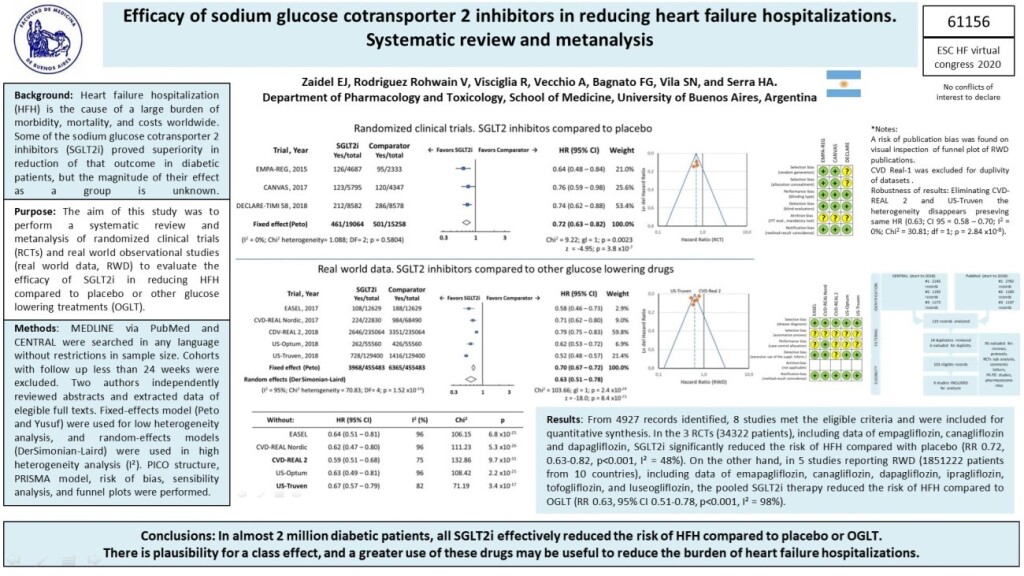
En el metanálisis presentado en el congreso europeo de insuficiencia cardiaca (10), demostramos el efecto de clase en las hospitalizaciones por IC. Más aún, los resultados se replicaron en el “mundo real”, fuera de los ensayos clínicos. La serie de estudios CVD-REAL liderados por el Dr. Kosiborod, así como los estudios de las bases de datos EASEL, US-Truven y Optum, han comprobado similar tasa de reducción de eventos de IC en pacientes diabéticos a quienes se les inicia la prescripción de i-SGLT2 agregados al tratamiento previo, o al compararlos con el inicio de otros antidiabéticos. En este metanálisis reunimos información de casi 2.000.000 de diabéticos (¡sí, 2 millones!). ¿Queda confirmado el beneficio de los i-SGLT2 en los eventos de IC en diabéticos? Claro que sí.
Figura 1: metanálisis de i-SGLT2 en diabéticos. De (9) https://doi.org/10.1002/ejhf.1963
Nueva serie de ensayos clínicos en pacientes con insuficiencia cardiaca
El paso más osado de los patrocinantes de estos fármacos fue realizar directamente ensayos clínicos en fase 3 de desenlaces CV con gliflozinas, sin realizar estudios básicos como curvas dosis-respuesta en relación a parámetros de IC, ni de escalamiento de dosis y seguridad. Sólo se extrapolaron los hallazgos en los ensayos clínicos de sujetos con diabetes y se iniciaron los fase 3. La epidemia actual de insuficiencia cardíaca y su impacto como principal causa de hospitalización en adultos en parte avalaría este proceso, incluso la FDA lo avaló y ha otorgado denominaciones de fast-track por considerar un fármaco o grupo de fármacos que potencialmente reducirán mortalidad u hospitalizaciones en insuficiencia cardiaca. Por suerte, ¡tuvieron éxito!
DAPA-HF (11), con dapagliflozina 10 mg (con opción de ajuste de dosis a 5 mg) marcó un hito en la historia de la IC, muchos médicos y decisores en salud creen que encarece el tratamiento, muchos pacientes se quejarán de “tener que tomar una pastilla más” todos los días. Sin embargo, los números y gráficos del ensayo clínico hablan por sí solos (tabla). Quienes acudieron a la presentación de los resultados en el congreso ESC 2019 recuerdan algo nunca antes visto, “standing ovation” mientras el Dr McMurray presentaba los resultados. Posteriormente, el EMPEROR-REDUCED demostría similares resultados y obviamente, el metanálisis de ambos (12, 13).
Aún se encuentran pendientes los resultados en una figurita difícil en la medicina, la insuficiencia cardíaca con fracción de eyección preservada (EMPEROR-Preserved y DELIVER) que es un grupo tan heterogéneo con varios fenotipos, y en el que la mayoría de los ensayos clínicos han presentado resultados controversiales. En poco tiempo sabremos si las gliflozinas son útiles en este escenario.
Y cuando ya parecía mucho, demostraron un efecto beneficioso en la insuficiencia renal.
Los pacientes con insuficiencia renal crónica, así como sus médicos tratantes, se encontraban quizás algo “neglected” (desatendidos) en la investigación farmacológica en comparación con otras patologías, muchos se resignaban a que indefectiblemente, con el paso de los años, la declinación en la función de los riñones llevaría eventualmente a la diálisis o trasplante, y que sólo los iECA o los ARA-II podría ayudarlos “un poco”, y en el mismo sentido de la inhibición del sistema renina angiotensina aldosterona, recientemente finerenone (antagonista de aldosterona de estructura no esteroide) demostró utilidad sólo en pacientes diabéticos (14).
Ya en los ensayos clínicos en diabetes había indicios de mejoría en los criterios de valoración renales, y llegó el DAPA-CKD. El estudio tuvo que suspenderse precozmente por los resultados positivos. ¡Se redujo casi a la mitad la necesidad de diálisis o trasplante o caída del filtrado 50% o muerte cardiovascular! (15) Como ventaja, las gliflozinas no provocan hiperkalemia, una limitante para la terapéutica en la mayoría de estos sujetos. Los nefrólogos ahora cuentan con varios grupos terapéuticos para enlentecer la progresión de la enfermedad.
Pero… todo esto… ¿es por la inhibición SGLT2?
La respuesta es un rotundo NO. Aún se encuentran en estudio los mecanismos de estos efectos pleiotrópicos. La mayoría de los autores y las revisiones catalogan los efectos en “atribuidos o no directamente a la inhibición SGLT2”. Aquí se resumen las principales hipótesis:
-Efectos atribuidos a la inhibición SGLT2: glucosuria, natriuresis, diuresis, reducción de la presión intraglomerular. Ello llevaría a reducción de precarga y postcarga, reducción del estrés parietal y mejora en el metabolismo energético miocárdico.
-Efectos no atribuidos a la inhibición SGLT2: efecto directo en el intercambiador sodio-protón (NHE), en adipoquinas, en la grasa epicárdica, efectos directos anti-fibróticos, efectos directos en el miocardio, y en el feedback glomérulo-tubular.
Lo que es destacable es que estos efectos se producen independientemente del nivel alcanzado de hemoglobina glicosilada, de peso corporal, y de la tasa de filtrado glomerular (18,19). Las investigaciones desarrolladas en las últimas décadas en Argentina por Cingolani, Ennis y col. acerca del intercambiador sodio-protón parecen cobrar un papel fundamental en la comprensión de los efectos pleiotrópicos de las gliflozinas (20).
Consideraciones finales
Si bien las gliflozinas se están posicionando como fármacos de primera línea en diabetes y en insuficiencia cardiaca, el no conocer específicamente su mecanismo de acción sigue siendo una debilidad mayor.
Así como a las estatinas (que poseen diversos efectos pleiotrópicos) se las llama estatinas y no inhibidores de la HMGCoA-reductasa, quien escribe considera que este grupo debería ser llamado “gliflozinas” más que “inhibidores del SGLT2”.
Es claro que existe un efecto de clase, bastante homogéneo, en la reducción de eventos de insuficiencia cardiaca y de insuficiencia renal, sin embargo, los resultados en desenlaces vasculares (ACV, infarto, revascularizaciones, eventos de miembros inferiores, muerte cardiovascular) son más heterogéneos.
Referencias:
1.Andrianesis V, Doupis J. The role of kidney in glucose homeostasis–SGLT2 inhibitors, a new approach in diabetes treatment. Expert Rev Clin Pharmacol 2013;6:519-39
2.Wright EM, Loo DD, Hirayama BA. Biology of human sodium glucose transporters. Physiol Rev 2011;91:733-94.
3.Barfuss DW, Schafer JA. Differences in active and passive glucose transport along the proximal nephron. Am J Physiol 1981;241:F322-32.
4.Marks J, Carvou NJ, Debnam ES, et al. Diabetes increases facilitative glucose uptake and GLUT2 expression at the rat proximal tubule brush border membrane. J Physiol 2003;553:137-45.
5.Rahmoune H, Thompson PW, Ward JM, et al. Glucose transporters in human renal proximal tubular cells isolated from the urine of patients with non-insulin-dependent diabetes. Diabetes 2005;54:3427-34
6.Tahara A, et al., Characterization and comparison of sodium-glucose cotransporter 2 inhibitors in pharmacokinetics, pharmacodynamics, and pharmacologic effects, J Pharmacol Sciences 2016.
7.Zinman B, Wanner C, Lachin JM, et al; EMPA-REG OUTCOME Investigators. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015 Nov 26;373(22):2117-28.
8.Zaidel EJ. En https://www.siacardio.com/educacion/farmacologia/nuevos-farmacos-para-la-diabetes-se-debe-involucrar-el-cardiologo/
9.Guías ADA 2021: publicada en: https://care.diabetesjournals.org/content/44/Supplement_1
10.Zaidel EJ, Rodriguez Rohwain V, Serra HA et al. Efficacy of sodium glucose cotransporter 2 inhibitors in reducing heart failure hospitalizations. systematic review and metanalysis. Eur J Heart Fail 2020 suppl. https://doi.org/10.1002/ejhf.1963
11.McMurray JJV, Solomon SD, Inzucchi SE, et al; DAPA-HF Trial Committees and Investigators. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019 Nov 21;381(21):1995-2008.
12.Packer M, Anker SD, Butler J et al; EMPEROR-Reduced Trial Investigators. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020 Oct 8;383(15):1413-1424.
13.Zannad F, Ferreira JP, Pocock SJ, et al. SGLT2 inhibitors in patients with heart failure with reduced ejection fraction: a meta-analysis of the EMPEROR-Reduced and DAPA-HF trials. Lancet. 2020 Sep 19;396(10254):819-829
14.Filippatos G, Anker SD, Agarwal R, et al; FIDELIO-DKD Investigators. Finerenone and Cardiovascular Outcomes in Patients with Chronic Kidney Disease and Type 2 Diabetes. 2020 Nov 16.
15.Heerspink HJL, Stefánsson BV, Correa-Rotter R, et al; DAPA-CKD Trial Committees and Investigators. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2020 Oct 8;383(15):1436-1446.
16.Zinman B, Inzucchi SE, Lachin JM, et al. Empagliflozin and Cerebrovascular Events in Patients With Type 2 Diabetes Mellitus at High Cardiovascular Risk. Stroke. 2017;48(5):1218-1225.
17.Fitchett DH, Zinman B, Inzucchi SE. Effect of Empagliflozin on Total Events of Myocardial Infarctions by Subtype in the EMPA-REG OUTCOME Trial. Circulation. 2020;142:A14959
18.Verma S, McMurray JJV. SGLT2 inhibitors and mechanisms of cardiovascular benefit: a state-of-the-art review. 2018 Oct;61(10):2108-2117.
19.Rosano G, Quek D, Martínez F. Sodium-Glucose Co-transporter 2 Inhibitors in Heart Failure: Recent Data and Implications for Practice. Card Fail Rev. 2020;6:e31.
20.Packer M. Activation and Inhibition of Sodium-Hydrogen Exchanger Is a Mechanism That Links the Pathophysiology and Treatment of Diabetes Mellitus With That of Heart Failure. Circulation. 2017 Oct 17;136(16):1548-1559.
21.Cingolani HE, Ennis IL. Sodium-hydrogen exchanger, cardiac overload, and myocardial hypertrophy. 2007 Mar 6;115(9):1090-100









































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados