En la evaluación de la IC y en el tratamiento específico de la congestión, desde hace más de dos décadas se ha planteado la importancia del tratamiento óptimo, sin que este pueda ser claramente identificado y la estrategia utilizada cuente con evidencia sólida. Congestión ¡¡¡CULPABLE!!! Más allá de la simplificación Con este poderoso título en
En la evaluación de la IC y en el tratamiento específico de la congestión, desde hace más de dos décadas se ha planteado la importancia del tratamiento óptimo, sin que este pueda ser claramente identificado y la estrategia utilizada cuente con evidencia sólida.
Congestión ¡¡¡CULPABLE!!!
Más allá de la simplificación
Con este poderoso título en el 2015 la Dra. Costanzo, una referente en Insuficiencia Cardiaca (IC), remarcaba lo que representa la congestión en este síndrome (1), por demás está mencionar, está vigente a la fecha.
En la evaluación de la IC y en el tratamiento específico de la congestión, desde hace más de dos décadas se ha planteado la importancia del tratamiento óptimo, sin que este pueda ser claramente identificado y la estrategia utilizada cuente con evidencia sólida. En el camino se han planteado innumerables cuestionamientos; desde su evaluación clínica, que no siempre es precisa y no necesariamente se correlaciona con la hemodinámica; hasta las diferentes estrategias empleadas, en medio de todo nos encontramos con el mito del aumento de la creatinina como un límite para detener la descongestión a pesar de ser efectiva; el dilema del uso de diuréticos de asa en infusión continua o en bolos, el momento ideal para escalar en la terapia y con qué; todos han sido temas de constante debate. El desarrollo de esta sub-especialidad, nos ha permitido incorporar nuevos conceptos, así como desarrollar otras habilidades que nos permita poner esta prueba de concepto en marcha, estandarizar el tratamiento e intentar transmitirlo para su generalización. Descongestionar es lo importante.
Considerando el trabajo de Boorsma E, et al (2), que resumen el planteamiento de la evaluación de la congestión, desde la premisa “no todo es igual”, plantearemos diferentes situaciones puntuales, que nos permitan tener una perspectiva más amplia.
El problema: La generalización, no toda congestión es igual
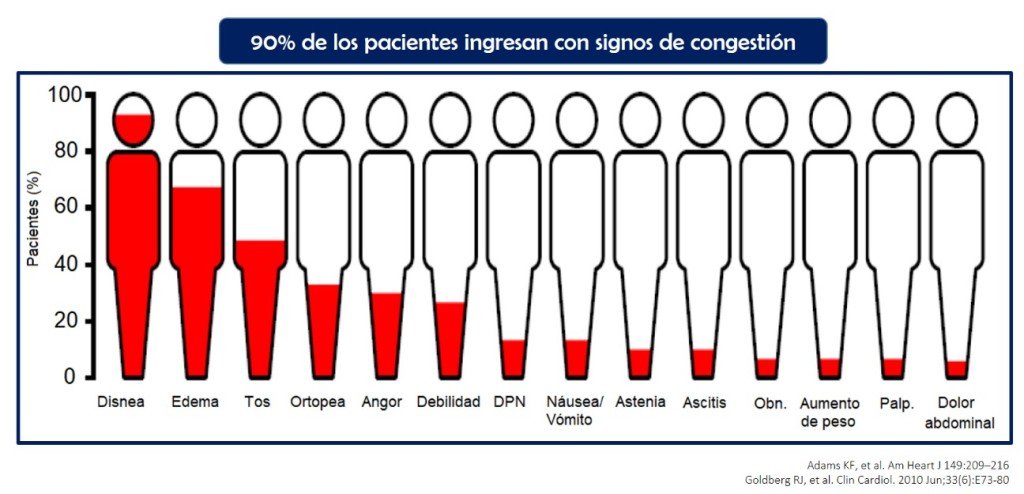
A pesar de la heterogeneidad de la IC aguda; siendo su extremo más peligroso el shock cardiogénico, tema que escapa del presente escrito; los diferentes registros de IC han demostrado que aproximadamente el 80-90% de pacientes presenta signos de congestión al ingreso, siendo el más prevalente la disnea y los diuréticos de asa la terapia más empleada (3–5). Tratarla es importante, el problema es identificarla.
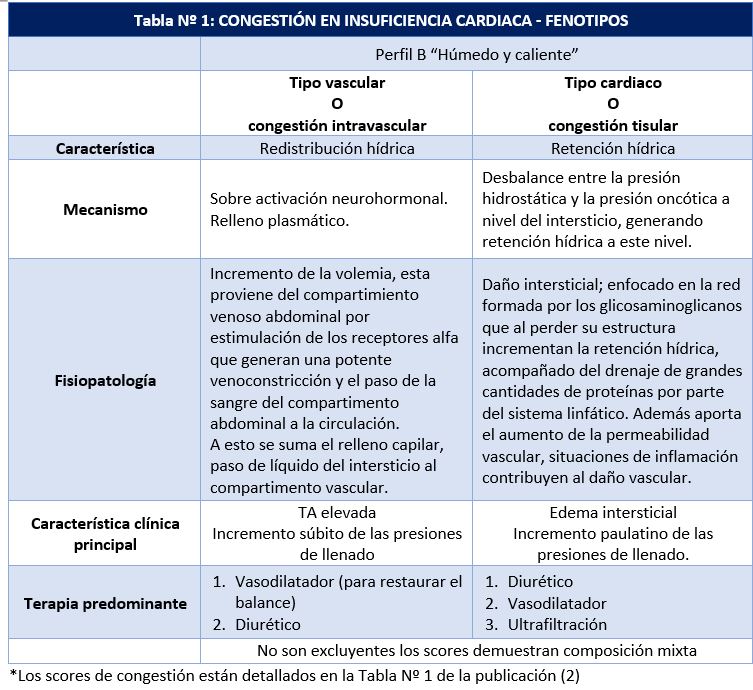
Siempre vigente, la clasificación planteada por la Dra. Stevenson, ampliamente utilizada y recomendada en las guías de IC. Aproximadamente el 95% de ingresos por IC descompensada corresponde al perfil B, húmedo y caliente; es decir, pacientes congestivos y bien perfundidos, los diferenciaremos en dos tipos: vascular y cardiaco. El tipo vascular, representado por pacientes con tensión arterial (TA) sistólica elevada, este grupo de pacientes se beneficia de vasodilatadores en primera instancia sumándose los diuréticos. Por otro lado, el tipo cardiaco, es mejor representado por pacientes con historia de IC con fracción de eyección (fey) reducida quienes lentamente empeoran con el tiempo, el edema intersticial aparece con el tiempo, en este grupo de paciente el diurético juegan un rol central (6).
Los autores del artículo de Nature Reviews Cardiology (2) plantean esta diferenciación bajo la denominación, congestión intravascular y congestión intersticial. En la tabla Nº 1 exponemos las principales características de acuerdo al fenotipo de la congestión.
Evaluando la congestión:
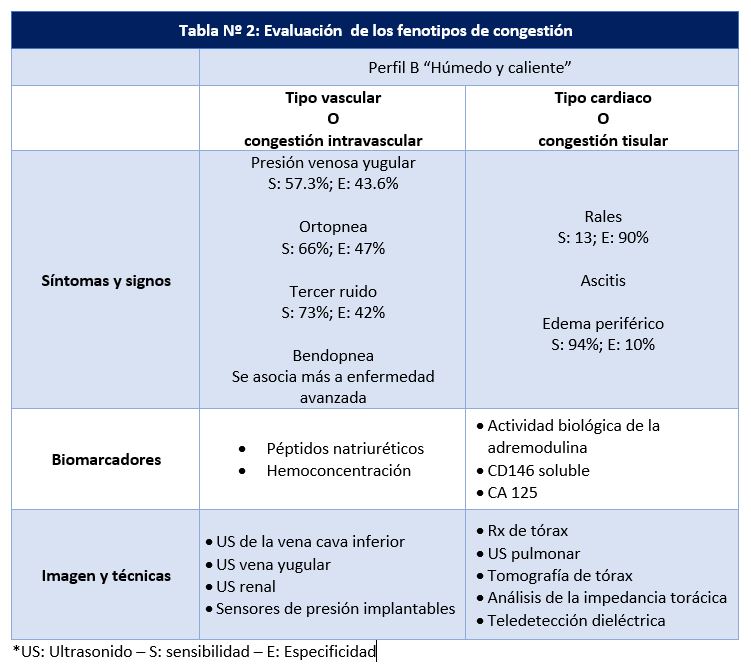
En la Tabla Nº 2 detallamos parámetros a considerar según cada fenotipo.
Mito: Si no tiene rales está descongestionado, tiene un poquito de edema periférico, está en peso seco.
Verdad: Es necesario ser objetivos, la clínica no alcanza
Para evaluar la congestión se han desarrollado diferentes scores, en su mayoría abarcan únicamente variables clínicas y sólo el desarrollado a partir del ASCEND-HF consideró incluir niveles de NT-pro-BNP. Su aplicación nos permite ser objetivos, debemos considerar las limitaciones de la clínica de forma aislada.
Es importante saber que, si bien el gold estándar es la evaluación hemodinámica para evidencia del incremento de las presiones de llenado, es evidente que no es una conducta de rutina para estos pacientes. La evaluación diagnóstica debe abarcar el uso sensato de la mayor cantidad de herramientas disponibles, conociendo las limitaciones para su uso racional. Así nos podemos encontrar sobre todo en pacientes con IC con fey reducida, en quienes la congestión no se presenta con signos y síntomas; en otro escenario, franca ortopnea sin evidencia de rales, secundario al aumento del drenaje linfático a nivel pulmonar. Por muchos años se relacionó la clínica con las presiones de llenado derechas o izquierdas, pero constantemente olvidamos la posibilidad del mistchmach de presiones, por ende, la clínica es imprecisa. Herramientas tradicionales también presentan limitaciones; por ejemplo, la Rx de tórax en paciente con presiones de llenado elevadas en el 30-40% no evidencia congestión y no se correlaciona con su severidad hasta en el 40% evidencia congestión mínima que no concuerda con elevadas presiones de llenado (7–9).
¿Y el peso? Es rutinario mencionarlo como parámetro para toma de decisiones. Cabe mencionar que el 54% de pacientes hospitalizados por un evento de IC aguda suben de ≤ 1 Kg durante el mes previo a su internación (10), por otro lado, a menudo la IC se asocia a caquexia. El peso es una medida que a pesar de aparente uso fácil es técnicamente desafiante y sus fluctuaciones no se relacionan con cambios en la redistribución de volumen. Existe una mala relación entre la pérdida de peso y el líquido perdido (11). Lo que si conocemos, es que el incremento de peso al alta se asocia a peor pronóstico (6).
Los biomarcadores nos brindan información valiosa, que se relaciona sobre todo con el pronóstico. Su utilidad la veremos según su aplicación. Así los péptidos natiuréticos no son recomendados para diagnóstico (6), sin embargo, solicitarlos al ingreso para evaluar su variación al alta, tiene otra perspectiva. Nuevos biomarcadores emergen en este sentido. Al comprender el fenotipo de congestión intersticial, la utilidad del CA 125 la entendemos con facilidad, otros marcadores como el CD 146 y la adremodulina, aún no son de uso masivo. La hemoconcentración, considerado un signo de congestión intravascular es un parámetro sencillo y rutinario. No se ha evaluado el monitoreo continuo del hematocrito como en los pacientes de diálisis (2).
Las técnicas emergentes, principalmente el ultrasonido, deben ser incorporadas por su versatilidad, accesibilidad y utilidad. La evidencia disponible avala su utilidad desde el departamento de emergencia hasta la evaluación de la congestión residual durante el delicado período de transición (12,13) , determinante del pronóstico a corto y largo plazo así lo recomienda la Sociedad Europea de Cardiología (14). Estudios y técnicas de mayor complejidad, se alejan del ideal para la masificación de su uso, lo cual no quiere decir no sean importante conocerlos ya que nos permite tener más opciones, sin embargo, no son de primera línea. La multimodalidad en la evaluación es la herramienta ideal.
Después de identificarla ¿Cómo la tratamos?
Mito: A pesar de buen balance negativo y buena diuresis, no mejora, es refractario.
Verdad: El problema de la generalización, omisión de la natriuresis, la aquaresis y la redistribución.
La mejor interpretación del compartimiento afectado, nos permitirá optimizar la natriuresis y determinar el momento adecuado de fomentar la redistribución. La tarea que no es sencilla, trataremos de simplificarla según lo propuesto por Boorsma EM et al (2), recordando que “no hay talla única”.
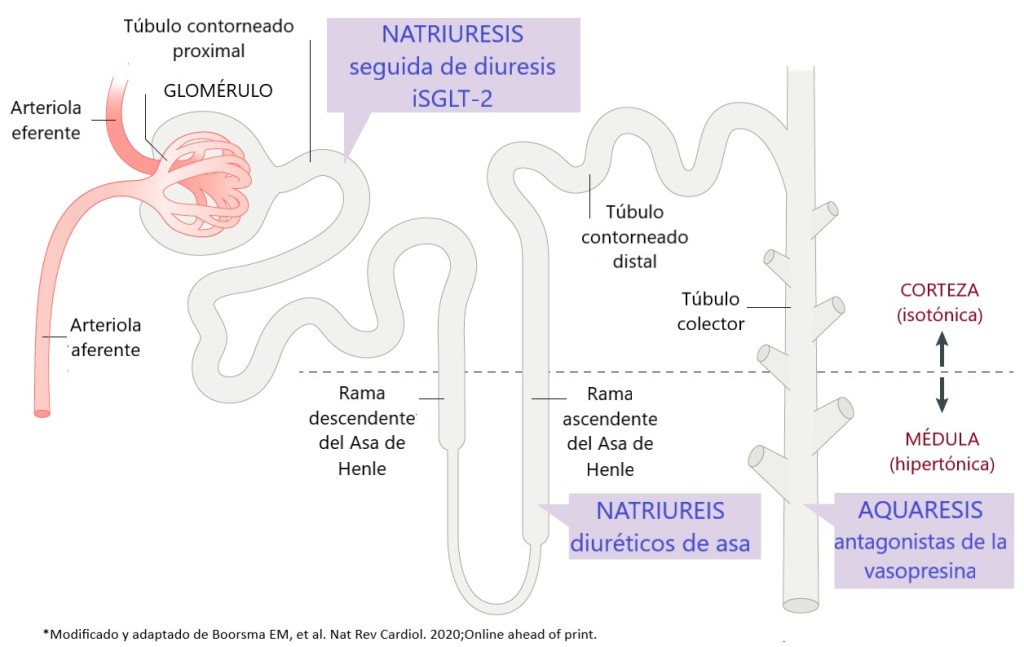
Partiendo de la premisa que la natriuresis conlleva a pérdida de agua libre, con los diuréticos de asa logramos el principal objetivo al tratar la congestión (administrado en dosis adecuada), es la medida inmediata durante la fase aguda; si el compartimento intravascular es el predominantemente afectado, tratar la hipertensión con vasodilatadores permite redistribuir hacia el compartimiento venoso el volumen y aumentar su capacitancia es lo ideal; sin embargo, no hay que descartar el compromiso del compartimento intersticial, por lo que se deben sumar diuréticos de asa. Con el paso del tiempo, los diuréticos de asa y las tiazidas pueden promover la reducción de la osmolaridad plasmática y generar diuresis hipotónica (2).
Conocedores de lo deletérea que es la congestión, la respuesta debe ser evaluada de manera constante, en las primeras 6 horas debemos conocer la respuesta y saber si logramos los objetivos, natriuresis y ritmo diurético adecuado; en este punto vale señalar, si el ritmo diurético es adecuado > 100-150 ml/h, probablemente la natriuresis está garantizada, sin embargo; natriuresis no es sinónimo de diuresis, por lo que, si no garantizamos de manera objetiva la eliminación del sodio, podemos generar hipovolemia al depletar el intravascular y por ende efectos deletéreos como real compromiso de la función renal (15,16). Si no hay respuesta inicial, debemos optimizar el tratamiento hasta lograrlo.
Para conocer la respuesta, a la clínica y variables mencionadas en el párrafo previo, agregemos biomarcadores y ultrasonido. De persistir parámetros de congestión, quizás se agotó el mecanismo inicial, es necesario sumar variables propias del paciente, como la poca respuesta inadecuada por daño renal subyacente; momento de enfocarnos en la redistribución, incrementando la osmolaridad, fomentamos que el remanente del intersticio pase a la circulación aumentando el flujo. Cabe mencionar que el incremento de la creatinina en el contexto de una efectiva descongestión no se asocia a peores resultados (17), situación constante de mala interpretación de este biomarcador que erróneamente lleva a detener la descongestión.
Las estrategias, natriuresis, aquaeresis y redistribución, no son excluyentes, son sinérgicas. De una u otra forma, hablamos de llegar antes y no enfrentarnos a la temida, resistencia a los diuréticos.
Fármacos que promueven natriuresis:
1.Diuréticos de asa
2.Tiazidas
3.Antagonistas del receptor de mineracorticoides
4.Acetazolamida
Estrategias para promover la aquaresis y redistribución:
1.Antagosnistas de la vasopresina (incrementa la aquaresis)
2.Inhibidores SGLT-2 (suma natriuresis)
3.Solución salina hipertónica (fomenta la redistribución)
4.Terapias de compresión
5.Incremento del flujo linfático
6.Bloqueo del nervio esplánico
Paradójicamente, a la fecha tenemos poca evidencia para cada uno de estos fármacos y estrategias. Cada uno de nosotros hemos ideado el algortimo ideal, apoyado en la literatura disponible y en la mejor comprensión de los episodios de descompensación, comúnente se ha usado las tiazidas como segundo diurético, sabremos la respuesta con el CLOROTIC trial que está curso. En el último tiempo contamos con mayor información de los beneficios que demuestran constantemente de los iSGLT-2, nada definitivo. Varios estudios se encuentran en marcha, probablemente el año que entra tendremos respuesta por acetazolamida.
No tenemos respuesta del segundo diurético ni del momento ideal. Las estrategias son complementarias, nuestro objetivo, descongestionar e identificar la congestión subclínica, no importa como, tenemos que hacerlo. Definitivamente, la congestión es ¡CULPABLE!.
Ver link AQUI
Bibliografía
1.Costanzo MR. Verdict In. Congestion Guilty! JACC Hear Fail. 2015;3(10):762–4.
2.Boorsma EM, ter Maaten JM, Damman K, Dinh W, Gustafsson F, Goldsmith S, et al. Congestion in heart failure: a contemporary look at physiology, diagnosis and treatment. Nat Rev Cardiol. 2020;Online ahead of print.
3.Chioncel O, Mebazaa A, Harjola VP, Coats AJ, Piepoli MF, Crespo-Leiro MG, et al. Clinical phenotypes and outcome of patients hospitalized for acute heart failure: the ESC Heart Failure Long-Term Registry. Eur J Heart Fail. 2017;19(10):1242–54.
4.Llauger L, Jacob J, Herrero-Puente P, Aguirre A, Suñén-Cuquerella G, et al. The CRAS-EAHFE study: Characteristics and prognosis of acute heart failure episodes with cardiorenal-anaemia syndrome at the emergency department. Eur Hear J Acute Cardiovasc Care. 2020;204887262092160.
5.Filippatos G, Angermann CE, Cleland JGF, Lam CSP, Dahlström U, Dickstein K, et al. Global Differences in Characteristics, Precipitants, and Initial Management of Patients Presenting with Acute Heart Failure. JAMA Cardiol. 2020;5(4):401–10.
6.Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2016;37(27):2129–200.
7.Stevenson LW, Perloff JK. The Limited Reliability of Physical Signs for Estimating Hemodynamics in Chronic Heart Failure. JAMA J Am Med Assoc. 1989;261(6):884–8.
8.Kelder JC, Cramer MJ, Van Wijngaarden J, Van Tooren R, Mosterd A, Moons KGM, et al. The diagnostic value of physical examination and additional testing in primary care patients with suspected heart failure. Circulation. 2011;124(25):2865–73.
9.Chakko S, Woska D, Martinez H, Marchena E de, Futterman L, Kessler K, et al. . Clinical, radiographic, and hemodynamic correlations in chronic congestive heart failure: conflicting results may lead to inappropriate care. Am J Med. 1991;90:353–9.
10.Chaudhry SI, Wang Y, Concato J, Gill TM, Krumholz HM. Patterns of weight change preceding hospitalization for heart failure. Circulation. 2007;116(14):1549–54.
11.Testani JM, Brisco MA, Kociol RD, Jacoby D, Bellumkonda L, Parikh CR, et al. Substantial discrepancy between fluid and weight loss during acute decompensated heart failure treatment. Am J Med [Internet]. 2015;128(7):776-783.e4. Available from: http://dx.doi.org/10.1016/j.amjmed.2014.12.020
12.Buessler A, Chouihed T, Duarte K, Bassand A, Huot-Marchand M, Gottwalles Y, et al. Accuracy of Several Lung Ultrasound Methods for the Diagnosis of Acute Heart Failure in the ED: A Multicenter Prospective Study. Chest [Internet]. 2020;157(1):99–110. Available from: https://doi.org/10.1016/j.chest.2019.07.017
13.Ceriani E, Casazza G, Peta J, Torzillo D, Furlotti S, Cogliati C. Residual congestion and long-term prognosis in acutely decompensated heart failure patients. Intern Emerg Med [Internet]. 2020; Available from: https://doi.org/10.1007/s11739-020-02326-y
14.Čelutkienė J, Lainscak M, Anderson L, Gayat E, Grapsa J, Harjola VP, et al. Imaging in patients with suspected acute heart failure: timeline approach position statement on behalf of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2020;22(2):181–95.
15.Galluzzo A, Frea S, Boretto P, Pidello S, Volpe A, Canavosio FG, et al. Spot urinary sodium in acute decompensation of advanced heart failure and dilutional hyponatremia: insights from DRAIN trial. Clin Res Cardiol [Internet]. 2020;(0123456789). Available from: https://doi.org/10.1007/s00392-020-01617-w
16.H. Verbrugge F, Dupont M, B. Bertrand P, Nijst P, Penders J, Dens J, et al. Determinants and impact of the natriuretic response to diuretic therapy in heart failure with reduced ejection fraction and volume overload. Acta Cardiol. 2015;70(3):265–73.
17.Brunner-La Rocca HP, Knackstedt C, Eurlings L, Rolny V, Krause F, Pfisterer ME, et al. Impact of worsening renal function related to medication in heart failure. Eur J Heart Fail. 2015;17(2):159–68.
2 comments







































2 Comments
Miguel angel Balderas reyez
junio 20, 2020, 10:48 amGracias
REPLYMiguel angel Balderas reyez
junio 20, 2020, 10:48 amGracias
REPLY