El tromboembolismo pulmonar agudo (TEP) se encuentra entre la principales causas de mortalidad cardiovascular, sólo por detrás de infarto de miocardio y del accidente cerebrovascular. Sin embargo, es la principal etiología implicada en las muertes cardiovasculares en pacientes hospitalizados. La disfunción del ventrículo derecho (VD) es la principal causa de mortalidad en éste escenario clínico.1,2
El tromboembolismo pulmonar agudo (TEP) se encuentra entre la principales causas de mortalidad cardiovascular, sólo por detrás de infarto de miocardio y del accidente cerebrovascular. Sin embargo, es la principal etiología implicada en las muertes cardiovasculares en pacientes hospitalizados. La disfunción del ventrículo derecho (VD) es la principal causa de mortalidad en éste escenario clínico.1,2
El embolismo pulmonar engloba a una población sumamente heterogénea. El 8% de los pacientes son considerados de alto riesgo y se manifiestan clínicamente con inestabilidad hemodinámica, shock o paro cardíaco. La tasa de mortalidad a 30 días en éste grupo se encuentra cercana al 22%. Más del 90% de los TEP son de riesgo bajo o intermedio. Los primeros tienen una muy baja tasa de complicaciones, con una mortalidad menor al 1%; mientras que en los segundos, cerca del 60% de todos los pacientes con TEP, presentan un riesgo de muerte que oscila entre el 3-15%.3-5 En éste último grupo radica el verdadero desafío de realizar una correcta estratificación del riesgo.
Numerosos estudios han corroborado la utilidad de la ecocardiografía en la estratificación del riesgo en un TEP agudo.6 Sin embargo, pocos examinan su utilidad pronóstica. Noura Dabbouseh y colaboradores publicaron recientemente una revisión del rol del ecocardiograma en el manejo del embolismo pulmonar agudo. A su vez, discuten los marcadores ecocardiográficos de riesgo, así como también del impacto que genera en la toma de decisiones clínicas.
Ecocardiograma en el diagnóstico de TEP agudo
La prueba diagnóstica de elección para un TEP agudo es la angiotomografía computada. Sin embargo, la naturaleza no invasiva, su ubicuidad y capacidad para realizarse junto a la cama del paciente, hacen de la ecocardiografía una alternativa diagnóstica atractiva. Ante la sospecha de un TEP agudo, existen múltiples signos ecocardiográficos que presentan una elevada especificidad:7
1-Trombo en cavidades derechas (99%)
2-Signo de McConnell, hipoquinesia de la pared libre con el sector apical conservado (97%).
3-Movimiento paradójico del septum interventricular (95%)
4-Dilatación del VD (80%)
Sin embargo, la sensibilidad del ecocardiograma es muy baja para descartar un TEP agudo (sólo la dilatación del VD presenta una sensibilidad cercana al 80%). No obstante, cuando un paciente presenta signos de descompensación hemodinámica o paro cardio respiratorio, una evaluación ecocardiográfica del VD sin particularidades excluye como diagnóstico presuntivo a un TEP agudo.8,9
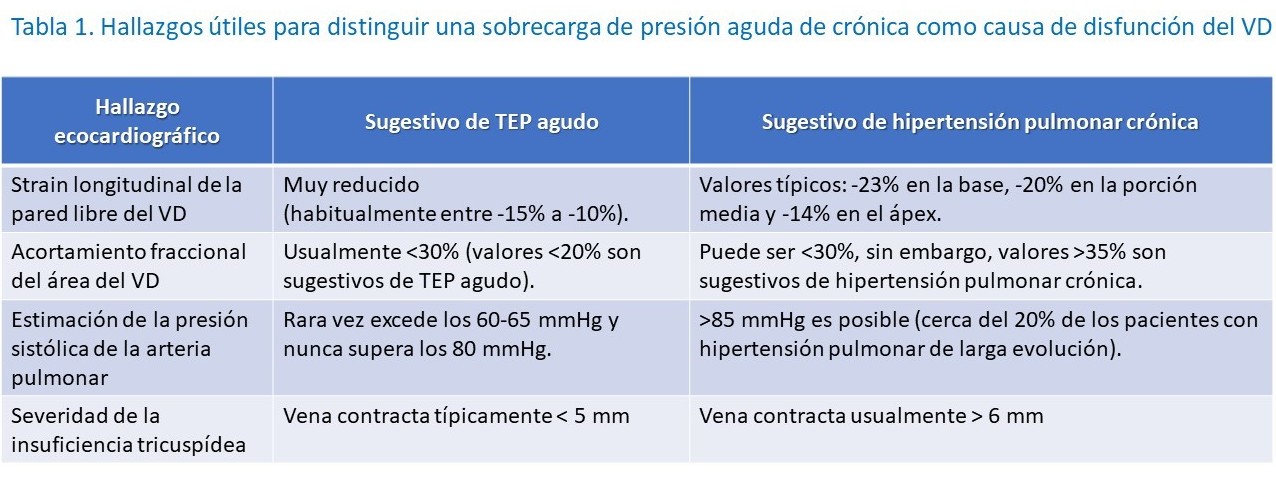
Distinguir sobrecarga de presión aguda versus crónica en el VD
En escenarios limitados, la ecocardiografía puede dilucidar la etiología de la disfunción del VD. Sin embargo, existen ciertos hallazgos ecocardiográficos en la evaluación del VD que orientan hacia una sobrecarga de presión aguda versus crónica (tabla 1). A pesar de su alta especificidad en el TEP agudo, el signo de McConnell no puede determinar de manera confiable la cronicidad de la disfunción del VD.10-13
Valor pronóstico de la ecocardiografía en poblaciones específicas
-Pacientes de bajo riesgo (ausencia de shock o inestabilidad hemodinámica y score sPESI de 0): el riesgo de muerte o complicaciones es <1%, eliminando así cualquier valor aditivo de realizar una ecocardiografía.4,14
-Pacientes con evidencia de disfunción del VD en la tomografía computada (TC): se considera como disfunción del VD cuando la relación entre los diámetros diastólicos del VD y del VI en la tomografía es ≥ 0.9 (sensibilidad del 84% y especificidad del 34%). Existe poca concordancia entre la disfunción del VD evaluada por TC y por ecocardiografía. Sin embargo, cuando en ambas modalidades se demuestra la afección de ésta cavidad, los pacientes suelen presentar mayores complicaciones (30% en los primeros 5 días vs 20% para la ecocardiografía y 3% cuando sólo está presente en la TC). A su vez, la mayor carga de coágulo en la TC se asocia con un mayor riesgo de disfunción del VD ecocardiográfico, mayor deterioro clínico a corto plazo y uso de trombólisis, pero no se asocia muerte cardiovascular.15-18
-Pacientes con evidencia de disfunción del VD por biomarcadores (troponina y péptidos natriuréticos): Los biomarcadores cardíacos ayudan a estratificar el riesgo de un TEP agudo. La sensibilidad y especificidad que tienen para predecir mortalidad precoz son del 85% y del 42-55% respectivamente, con un valor predictivo negativo que supera el 98% para ambos biomarcadores. En ausencia de elevación de biomarcadores, es poco probable que la ecocardiografía mejore la predicción del riesgo.4,18
Utilidad pronóstica de hallazgos ecocardiográficos específicos
Los siguientes hallazgos ecocardiográficos pueden tener un rol potencial en el pronóstico de los pacientes con TEP agudo, sobre todo en aquellos con riesgo intermedio-alto:
-Excursión sistólica del plano del anillo tricuspídeo (TAPSE): medición altamente reproducible de la función sistólica del VD. Es un mejor indicador pronóstico que la relación VD/VI en los pacientes normotensos. Un TAPSE <15–16 mm es un predictor independiente de trombólisis de rescate y de mortalidad cardiovascular. Un valor mayor a 18 mm prácticamente excluye la mortalidad relacionada con embolismo pulmonar.19,20
-Trombo en cavidades derechas: Se encuentra en aproximadamente el 2-4% de los TEP agudos. Aumenta claramente el riesgo de mortalidad a corto plazo, con tasas cercanas al 20%. La morfología, el tamaño o la movilidad del trombo intracardiaco no tienen efecto en la mortalidad.21-23
-Dilatación del VD: el VD se encuentra dilatado cuando relación VD/VI es ≥0,9 (similar a la TC). A su vez, se considera dilatado cuando los valores adquiridos en la vista apical de cuatro cámaras supera los 41 mm en la base del VD y los 35 mm a nivel del tercio medio. A mayor valor, mayor riesgo de resultados adversos.24
-Reducción del acortamiento fraccional del área (FAC), reducción de la onda S del anillo tricuspídeo por Doppler tisular o del aumento de la resistencia vascular pulmonar: son predictores independientes de complicaciones y de mortalidad intrahospitalaria.25
-Función del VD por ecografía 3D y strain del VD: son predictores independientes de resultados adversos hasta los 6 meses post TEP agudo sin descompensación hemodinámica.25,26
Implicancias terapéuticas de la ecocardiografía
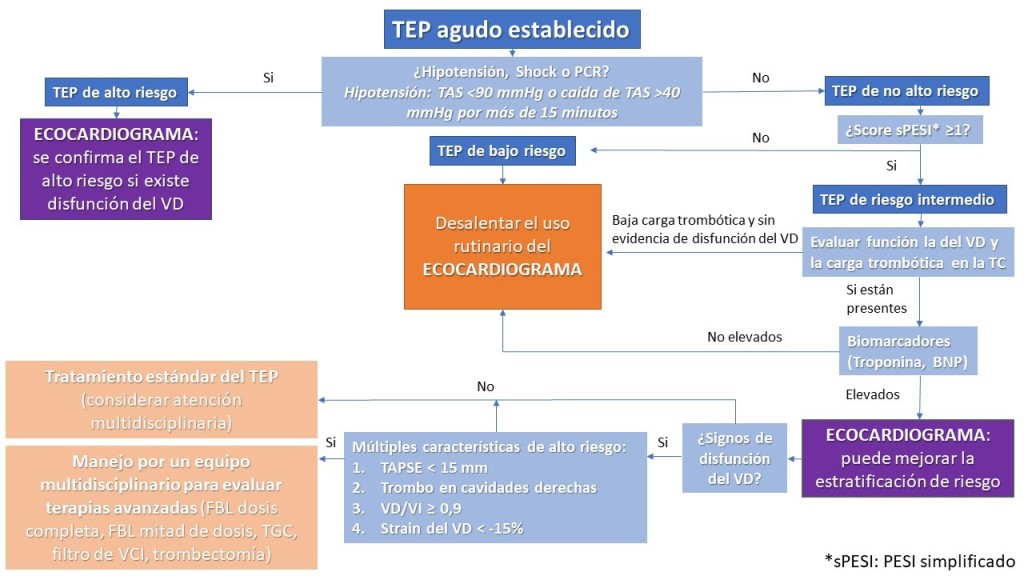
En la figura 1 se resume un algoritmo propuesto por el equipo Noura Dabbouseh y colaboradores, en cual se integra el rol de la ecocardiografía en la toma de decisiones de un paciente con TEP agudo.
Conclusión
La herramienta diagnóstica de elección para evaluar la vasculatura pulmonar en pacientes con sospecha de TEP es la angiotomografía computada. Esto es debido a que sólo en raras oportunidades el ecocardiograma brinda un diagnóstico de certeza, ya que depende de la detección de trombos intracavitarios (en las cavidades derechas o en las ramas de la arteria pulmonar).
Existen múltiples signos que marcan la existencia de una sobrecarga de presión en las cavidades derechas, como lo son la dilatación del VD, relación VD/VI ≥0.9, signo de Mc Connell, signo del 60/60 (tiempo a pico en el flujo pulmonar < 60 mseg y gradiente del jet de insuficiencia tricuspídea menor a 60 mmHg). Sin embargo, los mismos carecen de una sensibilidad adecuada para poder descartar un TEP. Recientemente se publicó un artículo de Luis Alfonso y colaboradores donde demuestran que la existencia de un notch sistólico en el flujo del tracto de salida del VD sugiere la presencia de un TEP masivo o submasivo, con una sensibilidad del 92%, especificidad del 99% y un área bajo la curva de 0,96, valores muy superiores a los parámetros previamente nombrados.27
Al momento de evaluar la probabilidad clínica de que un paciente hemodinámicamente estable presente un embolismo pulmonar, los scores más utilizados (Wells, Geneva) no incluyen ninguna variable ecocardiográfica. Sin embargo, ante la sospecha de un TEP de alto riesgo, la ecocardiografía es ampliamente aceptada y confirma la etiología de la inestabilidad hemodinámica al diagnosticar una severa disfunción del VD. Permitiendo así establecer un tratamiento reperfusión primaria (trombólisis).
¿Qué utilidad tiene un ecocardiograma en pacientes de bajo riesgo (normotensos con score sPESI de 0)? En éste grupo poblacional, una ecocardiografía rara vez produce hallazgos adicionales, por lo cual se debería desalentar su uso rutinario.
¿Qué información brinda en los pacientes de riesgo intermedio (normotensos con score sPESI de ≥1)? La mayor utilidad de la ecocardiografía se da en los pacientes que presentan signos de compromiso del VD en la TC o alta carga trombótica en las arterias pulmonares y biomarcadores elevados (troponina y BNP). Éstos pacientes conforman un subgrupo de riesgo intermedio-alto. La ecocardiografía deberá evaluar si existen múltiples marcadores de alto riesgo, como lo son el TAPSE < 17 mm, la presencia de trombos en cavidades derechas, relación VD/VI ≥0.9, una onda S del anillo tricuspídeo <9.5 cm/s, un FAC <35% y un strain de la pared libre del VD menor a -20%. La coexistencia de muchos de ellos puede ayudar a identificar a aquellos pacientes que se podrían beneficiar con un tratamiento más agresivo. Aunque, no existe a la fecha ninguna estratificación de riesgo validada con éstos marcadores ecocardiográficos. Por tal motivo, ante estos hallazgos, se sugiere realizar una evaluación multidisciplinaria para establecer el mejor esquema terapéutico en forma individualizada (trombolíticos sistémicos en dosis completa o a mitad de dosis, trombólisis guiada por catéter, estrecho monitoreo en unidad de cuidados intensivos).
Los estudios venideros deben tratar de incorporar éstos los hallazgos ecocardiográficos en los modelos de estratificación de riesgo existentes, particularmente para pacientes de riesgo intermedio-alto.
Ver link AQUI
Referencias
1-Jiménez D, de Miguel-Díez J, Guijarro R, et al. Trends in the management and outcomes of acute pulmonary embolism: analysis from the RIETE registry. J Am Coll Cardiol 2016;67:162–70.
2-Konstantinides SV, Vicaut E, Danays T, et al. Impact of Thrombolytic Therapy on the Long-Term Outcome of Intermediate-Risk Pulmonary Embolism. J Am Coll Cardiol 2017;69:1536–44.
3-Becattini C, Agnelli G, Lankeit M, et al. Acute pulmonary embolism: mortality prediction by the 2014 European Society of cardiology risk stratification model. Eur Respir J 2016;48:780–6.
4-Jiménez D, Kopecna D, Tapson V, et al. Derivation and validation of multimarker prognostication for normotensive patients with acute symptomatic pulmonary embolism. Am J Respir Crit Care Med 2014;189:718–26.
5-Jimenez D, Lobo JL, Fernandez-Golfin C, et al. Effectiveness of prognosticating pulmonary embolism using the ESC algorithm and the Bova score. Thromb Haemost 2016;115:827–34.
6-Cho JH, Kutti Sridharan G, Kim SH, et al. Right ventricular dysfunction as an echocardiographic prognostic factor in hemodynamically stable patients with acute pulmonary embolism: a meta-analysis. BMC Cardiovasc Disord 2014;14:64.
7-Fields JM, Davis J, Girson L, et al. Transthoracic echocardiography for diagnosing pulmonary embolism: a systematic review and meta-analysis. J Am Soc Echocardiogr 2017;30:714–23.
8-Konstantinides SV, Torbicki A, Agnelli G, et al. 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J 2014;35:997–1053. 69a-69k.
9-Levitov A, Frankel HL, Blaivas M, et al. Guidelines for the appropriate use of Bedside general and cardiac ultrasonography in the evaluation of critically ill Patients-Part II: cardiac ultrasonography. Crit Care Med 2016;44:1206–27.
10-Ichikawa K, Dohi K, Sugiura E, et al. Ventricular function and dyssynchrony quantified by speckle-tracking echocardiography in patients with acute and chronic right ventricular pressure overload. J Am Soc Echocardiogr 2013;26:483–92.
11-Wright L, Dwyer N, Power J, et al. Right ventricular systolic function responses to acute and chronic pulmonary hypertension: assessment with myocardial deformation. Journal of the American Society of Echocardiography 2016;29:259–66.
12-López-Candales A, Edelman K. Right ventricular outflow tract systolic excursion: a distinguishing echocardiographic finding in acute pulmonary embolism. Echocardiography 2013;30:649–57.
13-Mediratta A, Addetia K, Medvedofsky D, et al. Echocardiographic diagnosis of acute pulmonary embolism in patients with McConnell’s sign. Echocardiography 2016;33:696–702.
14-Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American heart association. Circulation 2011;123:1788–830.
15-Barrios D, Morillo R, Lobo JL, et al. Assessment of right ventricular function in acute pulmonary embolism. Am Heart J 2017;185:123–9.
16-Dudzinski DM, Hariharan P, Parry BA, et al. Assessment of right ventricular strain by computed tomography versus echocardiography in acute pulmonary embolism. Acad Emerg Med 2017;24:337–43.
17-Weekes AJ, Oh L, Thacker G, et al. Interobserver and intraobserver agreement on qualitative assessments of right ventricular dysfunction with echocardiography in patients with pulmonary embolism. J Ultrasound Med 2016;35:2113–20.
18-Konstantinides SV, Torbicki A, Agnelli G, et al. 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J 2014;35:997–1053. 69a-69k.
19-Lobo JL, Holley A, Tapson V, et al. Prognostic significance of tricuspid annular displacement in normotensive patients with acute symptomatic pulmonary embolism. J Thromb Haemost 2014;12:1020–7.
20-Paczyńska M, Sobieraj P, Burzyński Lukasz, et al. Tricuspid annulus plane systolic excursion (TAPSE) has superior predictive value compared to right ventricular to left ventricular ratio in normotensive patients with acute pulmonary embolism. Aoms 2016;5:1008–14.
21-Torbicki A, Galié N, Covezzoli A, et al. Right heart thrombi in pulmonary embolism: results from the International cooperative pulmonary embolism registry. J Am Coll Cardiol 2003;41:2245–51.
22-Bikdeli B, Lobo JL, Jiménez D, et al. Early use of echocardiography in patients with acute pulmonary embolism: findings from the RIETE registry. J Am Heart Assoc 2018;7:e009042.
23-Barrios D, Rosa-Salazar V, Morillo R, et al. Prognostic significance of right heart thrombi in patients with acute symptomatic pulmonary embolism: systematic review and meta-analysis. Chest 2017;151:409–16.
24-Khemasuwan D, Yingchoncharoen T, Tunsupon P, et al. Right ventricular echocardiographic parameters are associated with mortality after acute pulmonary embolism. J Am Soc Echocardiogr 2015;28:355–62.
25-Lee K, Kwon O, Lee E-J, et al. Prognostic value of echocardiographic parameters for right ventricular function in patients with acute non-massive pulmonary embolism. Heart Vessels 2019;34:1187.
26-Vitarelli A, Barilla F, Capotosto L, et al. Right ventricular function in acute pulmonary embolism: a combined assessment by three-dimensional and speckle-tracking echocardiography. J Am Soc Echocardiogr 2014;27:329–38.
27-Afonso L, Sood A, AkintoyeJ E, et al. A Doppler Echocardiographic Pulmonary Flow Marker of Massive or Submassive Acute Pulmonary Embolus. Am Soc Echocardiogr 2019;32:799-806.








































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados