“Informe de la prevalencia y resultados en los EEUU” Las enfermedades cardiovasculares y el cáncer son las principales causas de muerte en los países desarrollados, y en conjunto, son culpables de las dos terceras partes de la mortalidad total.1 Con frecuencia, éstas afecciones coexisten en una población cada vez más envejecida y con factores de
“Informe de la prevalencia y resultados en los EEUU”
Las enfermedades cardiovasculares y el cáncer son las principales causas de muerte en los países desarrollados, y en conjunto, son culpables de las dos terceras partes de la mortalidad total.1 Con frecuencia, éstas afecciones coexisten en una población cada vez más envejecida y con factores de riesgo compartidos, como el tabaquismo.2,3 Asimismo, los tratamiento antineoplásicos pueden tener efectos adversos a nivel cardiovascular como un infarto de miocardio, angina de pecho, disfunción ventricular, efectos deletéreos sobre las válvulas y el pericardio.4-9 A su vez, las neoplasias se asocian con un estado de hipercoagulabilidad, junto a un aumento en la activación y agregación plaquetaria.10 Un antecedente de cáncer se asocia de forma independiente con un mayor riesgo de eventos cardiovasculares mayores, incluidos mortalidad, revascularización coronaria y sangrados mayores.11,12
Por otro lado, la intervención coronaria percutánea (PCI) es la modalidad de revascularización más frecuente en pacientes con múltiples comorbilidades.13,14 Sin embargo, la mayoría de los ensayos clínicos controlados aleatorizados excluyen a individuos con cáncer activo o en tratamiento. Por consiguiente, los datos de la evolución clínica éstos pacientes luego de realizarse una PCI son limitados.
En el estudio publicado por la Dra. Potts y colaboradores tomaron a una gran cohorte de pacientes estadounidenses sometidos a una PCI. En ellos se evaluó el antecedente de cáncer o un cáncer activo al momento de la intervención, con el objetivo de analizar los resultados clínicos de los mismos.
Métodos y Resultados
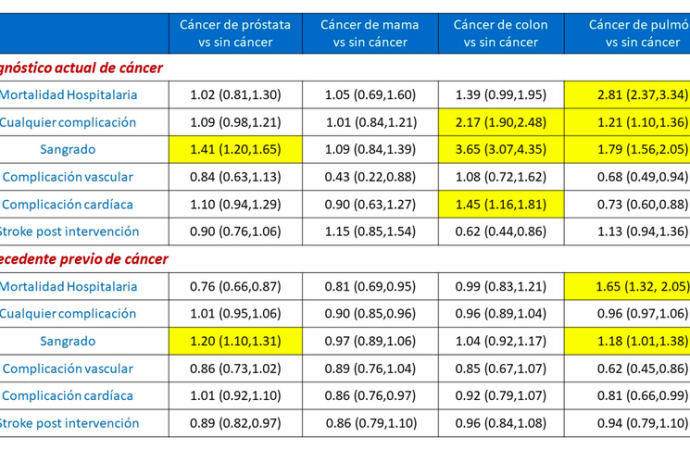
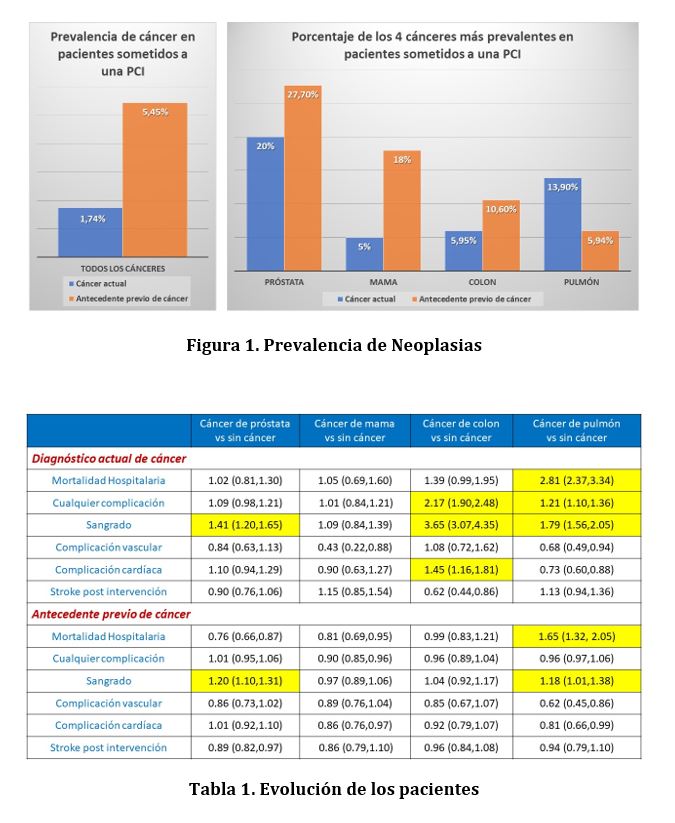
Los datos utilizados en este estudio derivan de la National Inpatient Sample (NIS), la cual es la mayor base de datos de pacientes hospitalizados de los EEUU. Se incluyeron a 6.571.034 pacientes sometidos a una PCI entre el 2004 y el 2014. Presentaron antecedentes de cáncer el 5.45% de la población, mientras que el 1.74% tenía cáncer activo al momento de la intervención. Ambas tasas aumentaron con el tiempo y los cuatro cánceres más comunes fueron el de próstata, mama, colon y pulmón (Figura 1). La evolución de los pacientes según el tipo de cáncer fue comparada con aquellos sin antecedentes neoplásicos y sus resultados se resumen en la Tabla 1.
La mortalidad intrahospitalaria es mayor en pacientes con diagnóstico de cáncer de pulmón, independientemente de la presencia de metástasis (OR de 2.44 sin metástasis y 3.44 con metástasis). Sin embargo, aquellos con diagnóstico de cáncer de colon y de próstata presentan una mayor mortalidad hospitalaria sólo en casos de poseer metástasis (OR de 1.95 y de 1.55 respectivamente). Los pacientes con cáncer de mama no presentaron diferencias en mortalidad frente a aquellos sin diagnóstico de neoplasia maligna.
Las complicaciones hemorrágicas fueron mayores en los pacientes con cáncer de colon (OR 3.65), de pulmón (OR 1.79) y de próstata (OR 1.41) independientemente de la presencia de metástasis. Los pacientes con cáncer de mama presentan mayores sangrados sólo en presencia de metástasis (OR 1.44).
Los pacientes con cáncer de colon y de pulmón presentaron una mayor estadía hospitalaria que el resto (media de 4 vs 2 días). Sin embrago, cuando se evalúa a los cuatro tipos de cáncer con presencia de metástasis, todos tuvieron una mayor estadía hospitalaria frente a aquellos sin neoplasias malignas. A su vez, se evidenció un aumento en los costos de hospitalización para los cuatro tipos de cáncer más frecuentes, sobre todo en los que presentaban metástasis.
Comentario
El cáncer entre los pacientes sometidos a una PCI es frecuente, con una prevalencia cercana al 10% (al incluir los casos con diagnóstico actual o previo). Los cuatro tipos más frecuentes de cáncer fueron el de próstata, de mama, de colon y de pulmón. El impacto pronóstico es específico según el tipo de cáncer, la presencia de metástasis y si la neoplasia se encuentra activa al momento de la intervención.
El diagnóstico de cáncer de pulmón se asoció con un aumento de la mortalidad hospitalaria. La presencia de metástasis, excepto en casos de cáncer de mama, se relacionó con una mayor mortalidad intrahospitalaria y con cualquier tipo de complicación, incluyendo sangrados.
¿A que se debe la incidencia elevada de complicaciones en los pacientes con cáncer post PCI? Es probable que los resultados adversos sean por causas multifactoriales. Las neoplasias malignas generan un estado de hipercoagulabilidad, por aumento de los factores de coagulación y de los reactantes de fase aguda, que conlleva a un elevado riesgo de los eventos tromboembólicos.15,16 La trombocitopenia, la presencia de enfermedad gastrointestinal maligna y las metástasis hepáticas pueden aumentar significativamente el riesgo de sangrado. Además, debemos considerar que post PCI se requiere administrar un esquema antiplaquetario para evitar complicaciones isquémicas coronarias. Esto conlleva a un aumento del riesgo de sangrado y se ve claramente reflejado al analizar la incidencia de las complicaciones hemorrágicas en los pacientes con cáncer de colon (21% en casos de cáncer activo frente al 3% de la población sin neoplasias malignas). La principal localización de los sangrados en éstos pacientes fue a nivel gastrointestinal.17 Éstas complicaciones obligan a suspender transitoriamente los antiplaquetarios, por lo tanto, se asocian también con un aumento de las complicaciones isquémicas.
Las comorbilidades como la anemia (debida a la hemólisis, a la quimioterapia, a las deficiencias nutricionales y a los mecanismos inmunomediados) generan un aumento del riesgo isquémico y hemorrágico.
Se debe reconocer a los pacientes con cáncer como un grupo poblacional con alto riesgo hemorrágico. Ésta consideración se vio reflejada en la selección del tipo de stent que se le implanta al paciente durante la PCI. Aquellos sin antecedentes neoplásicos recibieron un 74% de stents liberadores de drogas frente a un 39% de los casos de cáncer de colon y de pulmón activos, con el objetivo de disminuir al mínimo la duración del tratamiento antiplaquetario dual.18,19
El estudio recientemente analizado tiene una serie de limitaciones como todo estudio observacional desarrollado a partir de una base de datos. Entre ellas, se encuentra la falta de información de las causas de muerte de los pacientes. No está claro si el riesgo de mortalidad excesiva se debe a un mayor riesgo de mortalidad cardiovascular o si simplemente refleja muertes por cáncer. A su vez, la información proviene de aquellos pacientes que se encuentran hospitalizados, sin saber que sucede en el seguimiento a largo plazo de los mismos. Tampoco se encuentran unificadas las definiciones de las complicaciones hemorrágicas, como los sangrados mayores por Bleeding Academic Research Consortium (BARC) o por Thrombolysis in Myocardial Infarction (TIMI). Además, no se registró información al respecto de los esquemas antiplaquetarios y anticoagulantes que recibieron los pacientes.
En conclusión, es fundamental reconocer que los pacientes con cáncer representan a una población de elevada prevalencia entre aquellos sometidos a una PCI. El cáncer genera un estado protrombótico y proinflamatorio que conlleva a un mayor riesgo de complicaciones isquémicas y hemorrágicas comparados a la población sin antecedentes neoplásicos. Por lo tanto, se debe considerar a éste grupo como pacientes de alto riesgo. El tratamiento debe ser individualizado y se debe trabajar en forma conjunta entre cardiólogos y oncólogos para definir el momento más adecuado para realizar la intervención, así como el esquema antiplaquetario elegido y la duración del mismo. La Sociedad Europea de Cardiología recomienda una duración mínima de la terapia antiplaquetaria dual para limitar los riesgos de hemorrágicos.20
- – Ver link AQUI
Referencias
1-World Health Organization. WHO report on global status report on noncommunicable disease 2010. Geneva, Switzerland. http://apps.who.int/iris/bitstream/handle/10665/44579/9789240686458_eng.pdf;jsessionid=A524CA91BD92DAE84A6A5C8BAC9BE6E9? sequence=1 (3 May 2018).
2-Dreyer L, Olsen JH. Cancer risk of patients discharged with acute myocardial infarct. Epidemiology 1998;9:178–183.
3-Zoller B, Ji J, Sundquist J, et al. Risk of coronary heart disease in patients with cancer: a nationwide follow-up study from Sweden. Eur J Cancer 2012;48:121–128.
4-Levis BE, Binkley PF, Shapiro CL. Cardiotoxic effects of anthracycline-based therapy: what is the evidence and what are the potential harms? Lancet Oncol 2017; 18:e445–e456.
5-Iliescu C, Grines CL, Herrmann J, et al. SCAI expert consensus statement: evaluation, management, and special considerations of cardio-oncology patients in the cardiac catheterization laboratory (Endorsed by the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencionista). Catheter Cardiovasc Interv 2016;87:895–899.
6-Giza DE, Boccalandro F, Lopez-Mattei J, et al. Ischemic heart disease: special considerations in cardio-oncology. Curr Treat Options Cardiovasc Med 2017;19:37.
7-Hassan SA, Palaskas N, Kim P, et al. Chemotherapeutic agents and the risk of ischemia and arterial thrombosis. Curr Atheroscler Rep 2018;20:10.
8-Darby SC, Cutter DJ, Boerma M, et al. Radiation-related heart disease: current knowledge and future prospects. Int J Radiat Oncol Biol Phys 2010;76:656–665.
9-Heidenreich PA, Kapoor JR. Radiation induced heart disease: systemic disorders in heart disease. Heart 2009;95:252–258.
10-Blann AD, Dunmore S. Arterial and venous thrombosis in cancer patients. Cardiol Res Pract 2011;2011:394740.
11-Tabata N, Sueta D, Yamamoto E, et al. Outcome of current and history of cancer on the risk of cardiovascular events following percutaneous coronary intervention: a Kumamoto University Malignancy and Atherosclerosis (KUMA) study. Eur Heart J Qual Care Clin Outcomes 2018;4:290–300.
12-Landes U, Kornowski R, Bental T, et al. Long-term outcomes after percutaneous coronary interventions in cancer survivors. Coron Artery Dis 2017;28:5–10.
13-Mamas MA, Fath-Ordoubadi F, Danzi GB, et al. Prevalence and impact of co-morbidity burden as defined by the Charlson Co-morbidity Index on 30-day and 1- and 5-year outcomes after coronary stent implantation (from the Nobori-2 Study). Am J Cardiol 2015;116:364–371.
14-Anderson SG, Ratib K, Myint PK, et al; British Cardiovascular Intervention Society and National Institute for Cardiovascular Outcomes Research. Impact of age on Access site-related outcomes in 469,983 percutaneous coronary intervention procedures: insights from the British Cardiovascular Intervention Society. Catheter Cardiovasc Interv 2015;86:965–972.
15-Caine GJ, Stonelake PS, Lip GY, et al. The hypercoagulable state of malignancy: pathogenesis and current debate. Neoplasia 2002;4:465–473.
16-McCarthy CP, Steg G, Bhatt DL. The management of antiplatelet therapy in acute coronary syndrome patients with thrombocytopenia: a clinical conundrum. Eur Heart J 2017;38:3488–3492.
17-Shivaraju A, Patel V, Fonarow GC, et al. Temporal trends in gastrointestinal bleeding associated with percutaneous coronary intervention: analysis of the 1998-2006 Nationwide Inpatient Sample (NIS) database. Am Heart J 2011;162:1062–1068 e5.
18-Hess CN, Roe MT, Clare RM, et al. Relationship between cancer and cardiovascular outcomes following percutaneous coronary intervention. J Am Heart Assoc 2015;4: pii: e001779.
19-Velders MA, Boden H, Hofma SH, et al. Outcome after ST elevation myocardial infarction in patients with cancer treated with primary percutaneous coronary intervention. Am J Cardiol 2013;112:1867–1872.
20-Zamorano JL, Lancellotti P, Rodriguez Mu~noz D, et al; ESC Scientific Document Group. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: the Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J 2016;37:2768–2801.








































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados