La diabetes tipo II (DM2) está alcanzando proporciones epidémicas en poblaciones industrializadas debido a la combinación de la excesiva ingesta de calorías y la escasa actividad física. De manera alarmante, las patologías cardiovasculares asociadas a la diabetes son las principales causas de morbilidad y mortalidad en estos pacientes [1]. Sin embargo, el control glucémico intensivo
La diabetes tipo II (DM2) está alcanzando proporciones epidémicas en poblaciones industrializadas debido a la combinación de la excesiva ingesta de calorías y la escasa actividad física. De manera alarmante, las patologías cardiovasculares asociadas a la diabetes son las principales causas de morbilidad y mortalidad en estos pacientes [1]. Sin embargo, el control glucémico intensivo provocado por antidiabéticos clásicos ha proporcionado un éxito limitado en la disminución de las complicaciones cardiovasculares, incluso aumentando el riesgo de mortalidad. Estos antidiabéticos no mejoran la función celular del sistema cardiovascular, y pueden conducir a estados de hipoglucemia y/o aumento de peso, resistencia a insulina e hiperlipidemia [2]. Por estos motivos, existe una necesidad urgente de avanzar en el conocimiento de nuevas terapias que aborden factores de riesgo no glucémicos asociados a diabetes, y eviten estos inconvenientes.
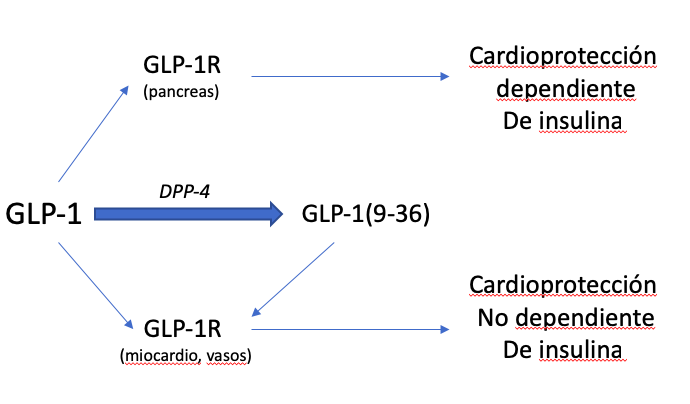
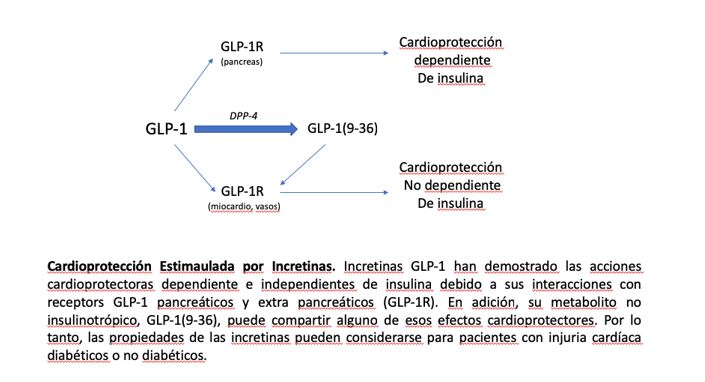
En este sentido, las incretinas como el polipéptido insulinotrópico (GIP) dependiente de la glucosa y el péptido 1 similar al glucagón (GLP-1), son hormonas entero-endocrinas liberadas al torrente sanguíneo en respuesta a la ingesta de nutrientes. Principalmente, GLP-1 aumenta la secreción de insulina a través de sus receptores acoplados a la proteína Gs (GLP-1R) en las células pancreáticas, de forma dependiente de glucosa, minimizando así el riesgo de hipoglucemia. Sin embargo, GLP-1 se degrada rápidamente por la dipeptidil peptidasa-4 (DPP-4), que escinde los dos aminoácidos N-terminales para producir un metabolito no insulinotrópico, denominado GLP-1(9-36) [3]. Sobre la base de este mecanismo, existen dos opciones terapéuticas para incrementar la señalización de GLP-1; los inhibidores de la DPP-4 (DPP-4i) y los miméticos de GLP-1 resistentes a la actividad de la DPP-4 (GLP-1m). Los primeros, ingeridos por vía oral, inducen efectos beneficiosos en la DM2 mediante la estimulación de las células beta pancreáticas y secreción de insulina. Reducen la producción de glucosa hepática y, en consecuencia, la hiperglucemia en ayunas y postprandial [4][5][6]. Además, podrían disminuir la presión arterial sistólica en los pacientes [7], debido probablemente a su influencia en la estabilidad de péptidos vasoconstrictores (véase SDF-1, neuropéptido-Y), y reducen los niveles de lípidos postprandiales (véase, triglicéridos, lipoproteínas VLDL/LDL y ácidos grasos), aunque no en ayunas [8][9]. Por otro lado, los GLP-1m se administran mediante inyección subcutánea, pero muestran mayores incrementos de proliferación de células β y secreción de insulina, y una mayor reducción de la producción de glucosa y de la hiperglucemia en ayunas y postprandial [10][11][12]. Estos fármacos pueden además retardar el vaciado gástrico y la motilidad intestinal, aumentar la saciedad y reducir el apetito, disminuyendo así el peso corporal y la resistencia a la insulina [13][14]. Reducen la presión arterial sistólica (independientemente de la pérdida de peso) [15] y los niveles de triglicéridos, ácidos grasos y lipoproteínas VLDL/LDL [16][17]. Mejoran además la función endotelial y promueven un efecto vasodilatador [18][19]. En definitiva, tanto los DPP-4i como el GLP-1m evidenciaron efectos cardioprotectores en modelos animales de isquemia/reperfusión [20][21][22], y redujeron eventos cardiovasculares en ensayos clínicos sin producir efectos secundarios no deseados [23]. Además, la infusión de GLP-1 nativo en humanos ha mejorado la función cardíaca y su recuperación después de condiciones isquémicas [24].
De interés, las acciones extra-glicémicas de DPP-4i y GLP-1m podrían justificarse por la presencia de GLP-1R en diferentes tejidos como el corazón, los vasos, los riñones, el hígado y el cerebro [22]. Los GLP-1m podrían producir mayor cardioprotección debido a que la liberación de la incretina también puede verse afectada en la DM2 [25]. Por lo tanto, incluso después de bloquear la actividad de la DPP-4, la cantidad de GLP-1 secretada podría ser insuficiente. Además, durante la administración de GLP-1m, se garantiza la producción de GLP-1(9-36) a partir de GLP-1 endógeno. GLP-1(9-36) puede conservar efectos beneficiosos para los pacientes con DM2, y así se ha demostrado en modelos de isquemia/reperfusión, mediante su interacción con receptores GLP-1R u otros [26]. Además, GLP-1 (9-36) induce vasodilatación a través de la formación de óxido nítrico [26], y protege contra la oxidación en células cardíacas y vasculares [27][28]. Adicionalmente, induce acciones anti-apoptóticas/-necróticas, -hipertróficas y -fibróticas en cardiomiocitos expuestos a altas concentraciones de glucosa y palmitato, de modo similar a GLP-1 [29]. Aunque debemos confirmar la seguridad cardiovascular a largo plazo de los tratamientos con DPP-4i y GLP-1m, es crucial continuar estudiando la estimulación de GLP-1R (u otros receptores específicos de GLP-1) en las células cardíacas y vasculares. Además, las acciones cardioprotectoras directas inducidas por estos fármacos podrían abrir su aplicación a diferentes cardiomiopatías no diabéticas.
Referencias:
1- Hossain P, Kawar B, El Nahas M: Obesity and diabetes in the developing world–a growing challenge. N Engl J Med 2007, 356:213–215.
2- Castagno D, Baird-Gunning J, Jhund PS, Biondi-Zoccai G, MacDonald MR, Petrie MC, et al: Intensive glycemic control has no impact on the risk of heart failure in type 2 diabetic patients: evidence from a 37,229 patient meta-analysis. Am Heart J 2011, 162:938–948.e2.
3- Hansen L, Deacon CF, Orskov C, Holst JJ: Glucagon-like peptide-1-(7-36)amide is transformed to glucagon-like peptide-1-(9-36)amide by dipeptidyl peptidase IV in the capillaries supplying the L cells of the porcine intestine. Endocrinology 1999, 140:5356–5363.
4- Arnolds S, Dellweg S, Clair J, Dain M-P, Nauck MA, Rave K, et al: Further improvement in postprandial glucose control with addition of exenatide or sitagliptin to combination therapy with insulin glargine and metformin: a proof-of-concept study. Diabetes Care 2010, 33:1509–1515.
5- Jadzinsky M, Pfützner A, Paz-Pacheco E, Xu Z, Allen E, Chen R, et al: Saxagliptin given in combination with metformin as initial therapy improves glycaemic control in patients with type 2 diabetes compared with either monotherapy: a randomized controlled trial. Diabetes Obes Metab 2009, 11:611–622.
6- Taskinen M-R, Rosenstock J, Tamminen I, Kubiak R, Patel S, Dugi KA, et al: Safety and efficacy of linagliptin as add-on therapy to metformin in patients with type 2 diabetes: a randomized, double-blind, placebo-controlled study. Diabetes Obes Metab 2011, 13:65–74.
7- Pratley RE, Nauck M, Bailey T, Montanya E, Cuddihy R, Filetti S, et al: Liraglutide versus sitagliptin for patients with type 2 diabetes who did not have adequate glycaemic control with metformin: a 26-week, randomised, parallel-group, open-label trial. Lancet 2010, 375:1447–1456.
8- Göke B, Gallwitz B, Eriksson J, Hellqvist A, Gause-Nilsson I, et al: Saxagliptin is non-inferior to glipizide in patients with type 2 diabetes mellitus inadequately controlled on metformin alone: a 52-week randomised controlled trial. Int J Clin Pract 2010, 64:1619–1631.
9- Gomis R, Espadero R-M, Jones R, Woerle HJ, Dugi KA: Efficacy and safety of initial combination therapy with linagliptin and pioglitazone in patients with inadequately controlled type 2 diabetes: a randomized, double-blind, placebo-controlled study. Diabetes Obes Metab 2011, 13:653–661.
10- DeFronzo RA, Triplitt C, Qu Y, Lewis MS, Maggs D, et al: Effects of exenatide plus rosiglitazone on beta-cell function and insulin sensitivity in subjects with type 2 diabetes on metformin. Diabetes Care 2010, 33:951–957.
11- Russell-Jones D, Vaag A, Schmitz O, Sethi BK, Lalic N, Antic S, et al: Liraglutide vs insulin glargine and placebo in combination with metformin and sulfonylurea therapy in type 2 diabetes mellitus (LEAD-5 met+SU): a randomised controlled trial. Diabetologia 2009, 52:2046–2055.
12- Drucker DJ, Buse JB, Taylor K, Kendall DM, Trautmann M, Zhuang D, et al: Exenatide once weekly versus twice daily for the treatment of type 2 diabetes: a randomised, open-label, non-inferiority study. Lancet 2008, 372:1240–1250.
13- Kolterman OG, Buse JB, Fineman MS, Gaines E, Heintz S, Bicsak TA, et al: Synthetic exendin-4 (exenatide) significantly reduces postprandial and fasting plasma glucose in subjects with type 2 diabetes. J Clin Endocrinol Metab 2003, 88:3082–3089.
14- DeFronzo RA, Ratner RE, Han J, Kim DD, Fineman MS, Baron AD: Effects of exenatide (exendin-4) on glycemic control and weight over 30 weeks in metformin-treated patients with type 2 diabetes. Diabetes Care 2005, 28:1092–1100.
15- Vilsbøll T, Zdravkovic M, Le-Thi T, Krarup T, Schmitz O, Courrèges J-P, et al: Liraglutide, a long-acting human glucagon-like peptide-1 analog, given as monotherapy significantly improves glycemic control and lowers body weight without risk of hypoglycemia in patients with type 2 diabetes. Diabetes Care 2007, 30:1608–1610.
16- Buse JB, Rosenstock J, Sesti G, Schmidt WE, Montanya E, Brett JH, et al: Liraglutide once a day versus exenatide twice a day for type 2 diabetes: a 26-week randomised, parallel-group, multinational, open-label trial (LEAD-6). Lancet 2009, 374:39–47.
17- Blevins T, Pullman J, Malloy J, Yan P, Taylor K, Schulteis C, et al: exenatide once weekly resulted in greater improvements in glycemic control compared with exenatide twice daily in patients with type 2 diabetes. J Clin Endocrinol Metab 2011, 96:1301–1310.
18- Nikolaidis LA, Mankad S, Sokos GG, Miske G, Shah A, Elahi D, et al: Effects of glucagon-like peptide-1 in patients with acute myocardial infarction and left ventricular dysfunction after successful reperfusion. Circulation 2004, 109:962–965.
19- Nyström T, Gutniak MK, Zhang Q, Zhang F, Holst JJ, Ahrén B, et al: Effects of glucagon-like peptide-1 on endothelial function in type 2 diabetes patients with stable coronary artery disease. Am J Physiol Endocrinol Metab 2004, 287:E1209–1215.
20- Sauvé M, Ban K, Momen MA, Zhou Y-Q, Henkelman RM, Husain M, et al: Genetic deletion or pharmacological inhibition of dipeptidyl peptidase-4 improves cardiovascular outcomes after myocardial infarction in mice. Diabetes 2010, 59:1063–1073.
21- Hausenloy DJ, Whittington HJ, Wynne AM, Begum SS, Theodorou L, Riksen N, et al: Dipeptidyl peptidase-4 inhibitors and GLP-1 reduce myocardial infarct size in a glucose-dependent manner. Cardiovasc Diabetol 2013, 12:154.
22- Anagnostis P, Athyros VG, Adamidou F, Panagiotou A, Kita M, Karagiannis A, et al: Glucagon-like peptide-1-based therapies and cardiovascular disease: looking beyond glycaemic control. Diabetes Obes Metab 2011, 13:302–312.
23- Petrie JR: The cardiovascular safety of incretin-based therapies: a review of the evidence. Cardiovasc Diabetol 2013, 12:130.
24- Sokos GG, Bolukoglu H, German J, Hentosz T, Magovern GJ Jr, Maher TD, et al: Effect of glucagon-like peptide-1 (GLP-1) on glycemic control and left ventricular function in patients undergoing coronary artery bypass grafting. Am J Cardiol 2007, 100:824–829.
25- Bagger JI, Knop FK, Lund A, Vestergaard H, Holst JJ, Vilsbøll T: Impaired regulation of the incretin effect in patients with type 2 diabetes. J Clin Endocrinol Metab 2011, 96:737–745.
26- Ban K, Noyan-Ashraf MH, Hoefer J, Bolz S-S, Drucker DJ, Husain M: Cardioprotective and vasodilatory actions of glucagon-like peptide 1 receptor are mediated through both glucagon-like peptide 1 receptor-dependent and -independent pathways. Circulation 2008, 117:2340–2350.
27- Mima A, Hiraoka-Yamomoto J, Li Q, Kitada M, Li C, Geraldes P, Matsumoto M, et al: Protective effects of GLP-1 on glomerular endothelium and its inhibition by PKCβ activation in diabetes. Diabetes 2012, 61:2967–2979.
28- Read PA, Khan FZ, Heck PM, Hoole SP, Dutka DP: DPP-4 inhibition by sitagliptin improves the myocardial response to dobutamine stress and mitigates stunning in a pilot study of patients with coronary artery disease. Circ Cardiovasc Imaging 2010, 3:195–201.
29- Picatoste B, Ramírez E, Caro-Vadillo A, Iborra C, Egido J, Tuñón J, et al: Sitagliptin Reduces Cardiac Apoptosis, Hypertrophy and Fibrosis Primarily by Insulin-Dependent Mechanisms in Experimental type-II Diabetes. Potential Roles of GLP-1 Isoforms. PloS One 2013, 8:e78330.
1 comment







































1 Comment
Martín Emilio Rojas Cardona
agosto 30, 2021, 10:34 pmDr, Excelente explicación.
REPLY