Autores: Rodrigo Estévez-Loureiro, Tomas Benito-González, Felipe Fernández-Vázquez Comentario: El artículo referido realiza un análisis de la situación actual del tratamiento de la insuficiencia mitral funcional (IMF) desde el punto de vista transcatéter con el dispositivo de mayor utilización en el momento actual, MitraClip© (Abbott Vascular, Menlo Park, CA, US) y a la luz de los
Autores: Rodrigo Estévez-Loureiro, Tomas Benito-González, Felipe Fernández-Vázquez
Comentario:
El artículo referido realiza un análisis de la situación actual del tratamiento de la insuficiencia mitral funcional (IMF) desde el punto de vista transcatéter con el dispositivo de mayor utilización en el momento actual, MitraClip© (Abbott Vascular, Menlo Park, CA, US) y a la luz de los últimos ensayos aleatorizados: MITRA.FR y COAPT(1, 2). Se valora en el mismo, las diferencias entre los estudios intentando explicar ambos en conjunto, así como buscar los candidatos que más se beneficien para la reparación mitral percutánea.
La IMF, también conocida como IM secundaria, es resultado del remodelado del ventrículo izquierdo (VI) con velos mitrales razonablemente conservados desde el punto de vista estructural. La IMF moderada a severa puede estar presente en hasta un 50% de los pacientes con insuficiencia cardiaca (IC) congestiva (3) y la presencia de IM después del infarto de miocardio o en pacientes con miocardiopatía dilatada se asocia con un mayor riesgo de insuficiencia cardiaca y muerte (4-6). La indicación quirúrgica en pacientes con insuficiencia mitral funcional es controvertida, especialmente en aquellos que no requieren revascularización coronaria o que tienen disfunción ventricular severa(7). Se trata de un grupo de pacientes de alto riesgo quirúrgico en el que los estudios han mostrado resultados no concluyentes respecto al beneficio potencial de la intervención quirúrgica en términos de supervivencia(8). Además, la tasa de recurrencia en este subgrupo después de la cirugía es elevada, incluso con las técnicas modernas de anuloplastia (9-12). A pesar de ello, el manejo conservador de estos pacientes se ha relacionado con un pronóstico muy adverso(13). Así, el tratamiento médico aislado se asocia con una elevada tasa de ingresos por insuficiencia cardiaca, con los crecientes costes asistenciales que ello conlleva, y una muy alta mortalidad, con una supervivencia inferior al 50% a los 5 años en algunas series (14-16). En este contexto, las intervenciones transcatéter han surgido para llenar una gran necesidad no satisfecha. Desde la publicación del estudio EVEREST II hasta finales de 2018, la evidencia de MitraClip se ha basado en registros de vida real en los que la IMF ha supuesto aproximadamente el 70% de las indicaciones.
No ha sido hasta muy recientes fechas (finales de 2018) que han aparecido por fin dos estudios aleatorizados que comparan MitraClip frente a tratamiento médico óptimo en pacientes con IMF e IC, como se mencionaba previamente.
Los resultados de ambos estudios, con sus principales diferencias se muestran en las tablas del artículo comentado. Vamos a reflexionar sobre los puntos que, a nuestro entender, nos parecen los más relevantes.
1.Magnitud de la IM. Probablemente este es uno de los puntos más destacados que pueden explicar las diferencias. En el estudio MITRA-FR, siguiendo las recomendaciones de las guías de enfermedad de la ESC, se incluyó a pacientes con IMF severa definida como un orificio regurgitante efectivo (ORE) ≥ 20 mm2 o un volumen regurgitante > 30 ml. Esto hizo que el ORE promedio de los pacientes en este estudio fuese 31 ± 10 mm2. Por el contrario, en el estudio COAPT, siguiendo las guías americanas(17), consideraron que la IMF significativa era aquella con ORE ≥ 30 mm2 o un volumen regurgitante > 45 ml (ORE promedio, 41 ± 15 mm2¬). Además, en el MITRA-FR más de la mitad de los pacientes (52%) presentaba un ORE entre 20 y 30, mientras que en el COAPT el 87% de los pacientes tenían valores de ORE superiores a 30 mm2. En resumen, el COAPT incluyó pacientes con IMF más grave que, lógicamente, tendría un mayor impacto en los eventos de los pacientes al ser corregida de forma efectiva.
2.Volúmenes ventriculares. Los pacientes del estudio MITRA-FR presentaban en promedio volúmenes ventriculares más altos que los pacientes COAPT (volumen telediastólico indexado, 135 ± 35 ml/m2 frente a 101 ± 34 ml/m2). Eso quiere decir que la enfermedad estaba en una fase más avanzada en el estudio francés que en el americano. Junto con la anterior puede ser también una de las claves de las diferencias. Tratar poca IM en pacientes con volúmenes ventriculares muy dilatados puede que no tenga ningún efecto sobre los eventos cardiovasculares mayores.
3.Tratamiento médico óptimo. Este también es un punto fundamental para entender las diferencias. En el estudio MITRA.FR el tratamiento médico que los pacientes recibían antes de la aleatorización fue el que el médico responsable consideraba óptimo. Además, este podía ser modificado a lo largo del seguimiento sin que el comité del estudio pudiese controlar esta variable. Esto puede haber hecho que, a pesar de que las proporciones de fármacos de insuficiencia cardiaca presentadas fuesen las correctas al inicio del estudio, sus dosis pudieron ser modificadas posteriormente. Y de todos es sabido que la optimización de las dosis de los fármacos tiene un gran impacto en los eventos y clase funcional de los pacientes. Este efecto puede verse objetivamente en la gran mejoría en la clase funcional que experimentó el grupo de tratamiento médico del MITRA-FR. Sin embargo, en el COAPT existía un «comité de elegibilidad» que velaba y controlaba que cada paciente estuviese tratado con los fármacos adecuados y a dosis máxima tolerada antes de la aleatorización. Es por ello que en el seguimiento del COAPT se produjeron muy pocas modificaciones de las dosis respecto a las que había al inicio del estudio.
4.Rendimiento de MitraClip. Existen diferencias sustanciales de éxito y rendimiento del dispositivo. En el estudio MITRA-FR al 9% de los pacientes ni siquiera se les llegó a implantar el dispositivo. El número de complicaciones fue mayor en el MITRA-FR (14,5% frente al 8,5%) y el porcentaje de éxito del procedimiento al año también fue menor en el estudio francés (17% frente al 5% con IMF > 2+). Además, la durabilidad de la reparación mitral fue muy superior en el estudio COAPT con mantenimiento de IM ≤2+ en más del 90% de la población a 3 años. Y se ha comunicado recientemente, que el mantenimiento de este resultado es esencial para poder obtener un buen resultado clínico, con disminución de la mortalidad y de las rehospitalizaciones.
5.Selección de candidatos. El estudio COAPT fue especialmente cuidadoso en la selección de los candidatos. En el mismo se excluyeron pacientes que por sus características basales presentaban un pronóstico malo a corto plazo y en los que, posiblemente, la intervención no se acompañase de una mejoría clínica significativa. Entre estas exclusiones estaba la presencia de hipertensión pulmonar grave no reversible, la disfunción del ventrículo derecho moderada o grave, los pacientes con insuficiencia cardiaca en estadio D o aquellos pacientes hemodinámicamente inestables o con tratamiento inotrópico. Estos pacientes no figuraban en las exclusiones del estudio MITRA-FR. Además, todos los pacientes del MITRA-FR debían haber ingresado al menos una vez en el año previo, mientras que este requisito no era imprescindible en el estudio COAPT, lo que favorece la selección de una población menos evolucionada. La posible inclusión de estos casos junto a la de pacientes con ventrículos en una fase más avanzada de la enfermedad y poca regurgitación mitral pude que haya sido determinante a la hora de explicar sus resultados.
6.Tiempo de seguimiento. En el estudio COAPT, las curvas de supervivencia empiezan a separarse claramente alrededor del primer año de seguimiento. El MITRA-FR solo tenía un año de seguimiento cuando se presentó. Actualmente disponemos ya seguimientos a 3 años del COAPT (presentado en TCT 2019, confirma y todavía mejora los resultados de la reparación mitral transcatéter) y a 2 años de MITRA.FR (no hay cambios en eventos primario, pero si una disminución del número de hospitalizaciones entre los 12 y 24 meses en el grupo de intervención)(18). Es interesante ver como a medida que avanza el seguimiento en MITRA.FR y el TMO llega a su límite, el efecto del beneficio de la reparación mitral aparece.
7.Por último, debemos señalar que el estudio COAPT es más riguroso que el MITRA-FR. En el estudio francés, 43 pacientes fueron excluidos del protocolo en la rama de MitraClip debido a diversos motivos, lo cual supone el 28% de la muestra del brazo de intervención. Además, las numerosas pérdidas de variables secundarias como la calidad de vida, valores analíticos, clase funcional y, lo que es más llamativo, ecocardiogramas de control, hace que estos eventos no fuesen analizados en el estudio por poder estar sometidos a sesgos. En esta línea, el porcentaje de recidivas de IMF significativa al año es aproximado, lo cual resta exactitud a estos análisis.
Considerando en conjunto los dos estudios como resaltan los autores, creemos que COAPT es un experimento perfectamente ejecutado que pone de manifiesto que la IMF se asocia a una elevada mortalidad y que su corrección efectiva lleva a una mejoría pronóstica muy importante. En contraposición, MITRA.FR nos enseña que la elección del tratamiento óptimo para IC y que la optimización hasta las dosis máximas produce una importante mejoría sintomática en los pacientes y también reduce la IMF (no olvidemos que esta es un proceso dinámico que puede variar en el tiempo). Además, nos señala a qué pacientes probablemente no haya que tratar con esta terapia: pacientes en fase avanzada, con poca regurgitación mitral y sin estar al máximo optimizado de tratamiento.
Como se indica en el artículo, lo interesante de ambos estudios es que pueden tomarse en conjunto (asociados también a la extensa información que proviene de los registros de vida real) para definir cómo debemos seleccionar a los candidatos. Como se comenta previamente, parece claro que debemos evitar a los pacientes con estados avanzados (mayor dilatación ventricular), con IMF no grave y sin estar óptimamente tratados. Si queremos obtener resultados más positivos, nuestros candidatos deben estar en fases más precoces, con un importante grado de IMF (que esta sea realmente contributiva a la situación clínica), perfectamente tratados y además tener un muy buen resultado con el dispositivo (por lo que la selección anatómica y la experiencia del equipo implantador deben ser altas).
Teniendo en cuenta la cantidad de IM y el grado de dilatación ventricular parece que juegan un papel esencial a la hora de seleccionar candidatos, algunos autores han introducido recientemente el concepto de IM proporcionada o desproporcionada al grado de dilatación ventricular, como una herramienta para explicar las diferencias entre estos estudios y la futilidad del tratamiento percutáneo de la IMF(19). En su más reciente publicación(20), los autores defienden que aquellos pacientes con IMF desproporcionada a la dilatación ventricular (calculada como un ratio ORE/VTDVI >0.12) exhiben características de la IM primaria, en donde la cantidad de IM determina el pronóstico. Es en estos pacientes en los que el tratamiento transcatéter podría tener sentido. Sin embargo, estas asunciones no han sido todavía comprobadas en la práctica clínica, sino son elucubraciones en un marco teórico y no pueden ser generalizables. En un editorial reciente(21), se señalan todas las limitaciones de este concepto, como la infraestimación en el cálculo de los volúmenes ventriculares mediante Eco 2D, las limitaciones del cálculo del ORE en la IMF, la dependencia del mismo de la compliance de las cámaras cardiacas y de las condiciones de carga. Por ello, este concepto debe ser utilizado con cautela y no creemos que sea generalizable para la selección de candidatos. Es posible que la utilización de la fracción regurgitante (<50%) o el cálculo del área ORE 3D, mejore la selección de los grados más severos de IM(22).
Finalmente, debemos tener en cuenta los datos reflejados en COAPT y MITRA.FR nos hablan del paciente «promedio». Sin embargo, un subanálisis del estudio COAPT nos indica que mientras que la IMF sea muy relevante (ORE > 30 mm2) siempre se obtiene beneficio independientemente del grado de dilatación ventricular y que existe mejoría de calidad de vida, clase funcional más allá de la mejora de mortalidad o reingresos(23, 24). Además, en COAPT, se observó una reducción de la necesidad de trasplante cardiaco o asistencia ventricular. Por ello debemos individualizar cada caso y en nuestra opinión darle relevancia a la cantidad de IMF. Es por ellos que además de las reducciones de eventos mayores, tenemos que tener en cuenta que MitraClip se asocia también a una mejoría de esos eventos secundarios, pero relevantes. Debemos considerar estos objetivos también a la hora de seleccionar a los pacientes porque a veces esta terapia es lo único que puede servir para paliar síntomas muy avanzados.
En la siguiente figura creada por nuestro grupo de trabajo pretendemos resumir de un punto de vista práctico las características a evaluar para poder decidir si un paciente es candidato a MitraClip en función del resultado que se quiera obtener. 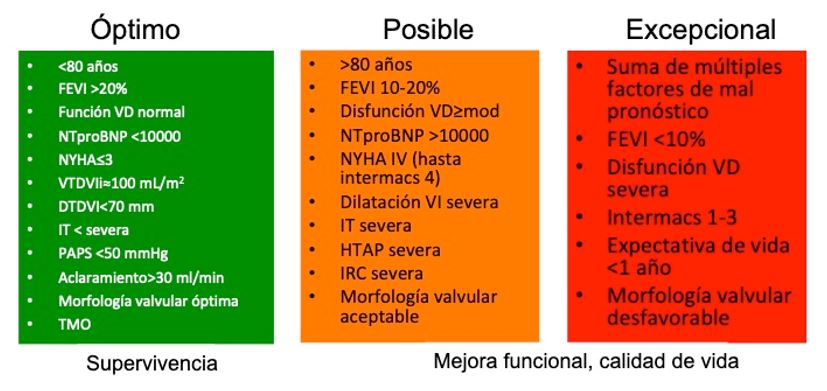
Figura 1. Criterios selección candidatos MitraClip con IMF
Referencias
1.Obadia JF, Messika-Zeitoun D, Leurent G, Iung B, Bonnet G, Piriou N, et al. Percutaneous Repair or Medical Treatment for Secondary Mitral Regurgitation. N Engl J Med 2018; 79:2297-2306..
2.Stone GW, Lindenfeld J, Abraham WT, Kar S, Lim DS, Mishell JM, et al. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. N Engl J Med 2018;379:2307-2318
3.Bursi F, Barbieri A, Grigioni F, Reggianini L, Zanasi V, Leuzzi C, et al. Prognostic implications of functional mitral regurgitation according to the severity of the underlying chronic heart failure: a long-term outcome study. Eur J Heart Fail 2010;12:382-8.
4.Robbins JD, Maniar PB, Cotts W, Parker MA, Bonow RO, Gheorghiade M. Prevalence and severity of mitral regurgitation in chronic systolic heart failure. Am J Cardiol 2003;91:360-2.
5.Trichon BH, Felker GM, Shaw LK, Cabell CH, O'Connor CM. Relation of frequency and severity of mitral regurgitation to survival among patients with left ventricular systolic dysfunction and heart failure. Am J Cardiol 2003;91:538-43.
6.Grigioni F, Enriquez-Sarano M, Zehr KJ, Bailey KR, Tajik AJ. Ischemic mitral regurgitation: long-term outcome and prognostic implications with quantitative Doppler assessment. Circulation. 2001;103:1759-64.
7.Baumgartner H, Falk V, Bax JJ, De Bonis M, Hamm C, Holm PJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017;38:2739-91.
8.Wu AH, Aaronson KD, Bolling SF, Pagani FD, Welch K, Koelling TM. Impact of mitral valve annuloplasty on mortality risk in patients with mitral regurgitation and left ventricular systolic dysfunction. J Am Coll Cardiol 2005;45:381-7.
9.Acker MA, Parides MK, Perrault LP, Moskowitz AJ, Gelijns AC, Voisine P, et al. Mitral-valve repair versus replacement for severe ischemic mitral regurgitation. N Engl J Med 2014;370:23-32.
10.Goldstein D, Moskowitz AJ, Gelijns AC, Ailawadi G, Parides MK, Perrault LP, et al. Two-Year Outcomes of Surgical Treatment of Severe Ischemic Mitral Regurgitation. N Engl J Med 2016;374:344-53.
11.Hung J, Papakostas L, Tahta SA, Hardy BG, Bollen BA, Duran CM, et al. Mechanism of recurrent ischemic mitral regurgitation after annuloplasty: continued LV remodeling as a moving target. Circulation. 2004;110:Ii85-90.
12.McGee EC, Gillinov AM, Blackstone EH, Rajeswaran J, Cohen G, Najam F, et al. Recurrent mitral regurgitation after annuloplasty for functional ischemic mitral regurgitation. J Thorac Cardiov Surg. 2004;128:916-24.
13.Agricola E, Ielasi A, Oppizzi M, Faggiano P, Ferri L, Calabrese A, et al. Long-term prognosis of medically treated patients with functional mitral regurgitation and left ventricular dysfunction. Eur J Heart Fail 2009;11:581-7.
14.Goel SS, Bajaj N, Aggarwal B, Gupta S, Poddar KL, Ige M, et al. Prevalence and outcomes of unoperated patients with severe symptomatic mitral regurgitation and heart failure: comprehensive analysis to determine the potential role of MitraClip for this unmet need. J Am Coll Cardiol. 2014;63:185-6.
15.Braunschweig F, Cowie MR, Auricchio A. What are the costs of heart failure? Europace : 2011;13 Suppl 2:ii13-7.
16.Ambrosy AP, Fonarow GC, Butler J, Chioncel O, Greene SJ, Vaduganathan M, et al. The global health and economic burden of hospitalizations for heart failure: lessons learned from hospitalized heart failure registries. J Am Coll Cardiol 2014;63:1123-33.
17.Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP, 3rd, Fleisher LA, et al. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2017;135:e1159-e95.
18.Iung B, Armoiry X, Vahanian A, Boutitie F, Mewton N, Trochu JN, et al. Percutaneous repair or medical treatment for secondary mitral regurgitation: outcomes at 2 years. Eur J Heart Fail 2019;21:1619-27.
19.Grayburn PA, Sannino A, Packer M. Proportionate and Disproportionate Functional Mitral Regurgitation: A New Conceptual Framework That Reconciles the Results of the MITRA-FR and COAPT Trials. JACC Cardiovasc imag 2019;12:353-62.
20.Packer M, Grayburn PA. New Evidence Supporting a Novel Conceptual Framework for Distinguishing Proportionate and Disproportionate Functional Mitral Regurgitation. JAMA cardiology. 2020. Feb 19. doi: 10.1001/jamacardio.2019.5971. [Epub ahead of print]
21.Hahn RT. Disproportionate Emphasis on Proportionate Mitral Regurgitation-Are There Better Measures of Regurgitant Severity? JAMA cardiology. 2020. Feb 19. doi: 10.1001/jamacardio.2019.6235. [Epub ahead of print]
22.Avenatti E, Mackensen GB, El-Tallawi KC, Reisman M, Gruye L, Barker CM, et al. Diagnostic Value of 3-Dimensional Vena Contracta Area for the Quantification of Residual Mitral Regurgitation After MitraClip Procedure. JACC Cardiovasc interv. 2019;12:582-91.
23.Asch FM, Grayburn PA, Siegel RJ, Kar S, Lim DS, Zaroff JG, et al. Echocardiographic Outcomes after Transcatheter Leaflet Approximation in Patients with Secondary Mitral Regurgitation: The COAPT Trial. J Am Coll Cardiol 2019;74:2969-2979.
24.Arnold SV, Chinnakondepalli KM, Spertus JA, Magnuson EA, Baron SJ, Kar S, et al. Health Status After Transcatheter Mitral-Valve Repair in Heart Failure and Secondary Mitral Regurgitation: COAPT Trial. J Am Coll Cardiol 2019;73:2123-32.








































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados