En el mundo existe un aumento progresivo de pacientes con insuficiencia cardiaca (IC) y enfermedad renal crónica (ERC), debido a las mejoras en los tratamientos de ambas patologías. (1) Epidemiología, fisiopatología y diagnóstico: La IC está definida por las guías de la Sociedad Europea de Cardiología 2016 y dividida en subgrupos: IC con fracción de
En el mundo existe un aumento progresivo de pacientes con insuficiencia cardiaca (IC) y enfermedad renal crónica (ERC), debido a las mejoras en los tratamientos de ambas patologías. (1)
Epidemiología, fisiopatología y diagnóstico:
La IC está definida por las guías de la Sociedad Europea de Cardiología 2016 y dividida en subgrupos: IC con fracción de eyección preservada ≥ 50% (IC-FEp), IC con fracción de eyección reducida <40% (IC-FEr) e IC con deterioro moderado o en rango intermedio entre 40 y 49% (IC-FEm). (2)
La ERC se define por el descenso persistente del filtrado glomerular (FGe) < 60ml/min/1,73m2. Se divide en estadios: Normal (FGe ≥60ml/min/1,73m2); Estadio 2 (FGe 45 a 59 ml/min/1,73m2); Estadio 3 (FGe 30 a 44ml/min/1,73m2), Estadio 4 (FGe 15 a 29ml/min/1,73m2); Estadio 5 (FGe <15ml/min/1,73m2).(3)
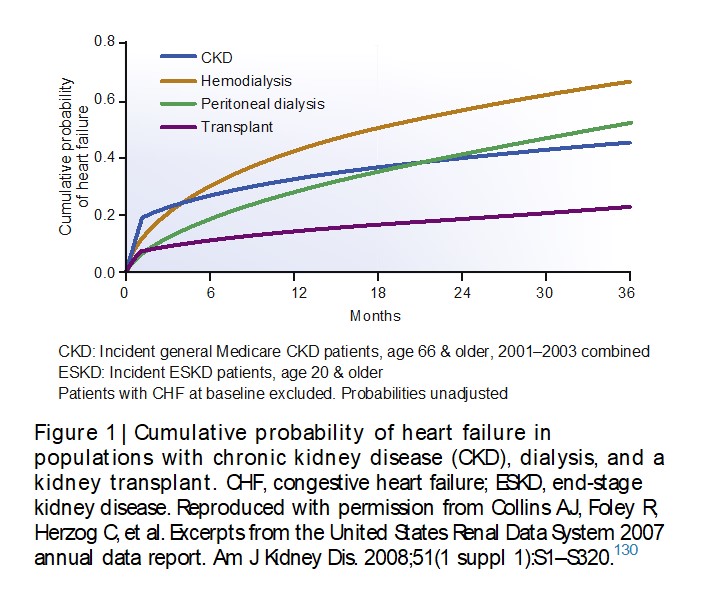
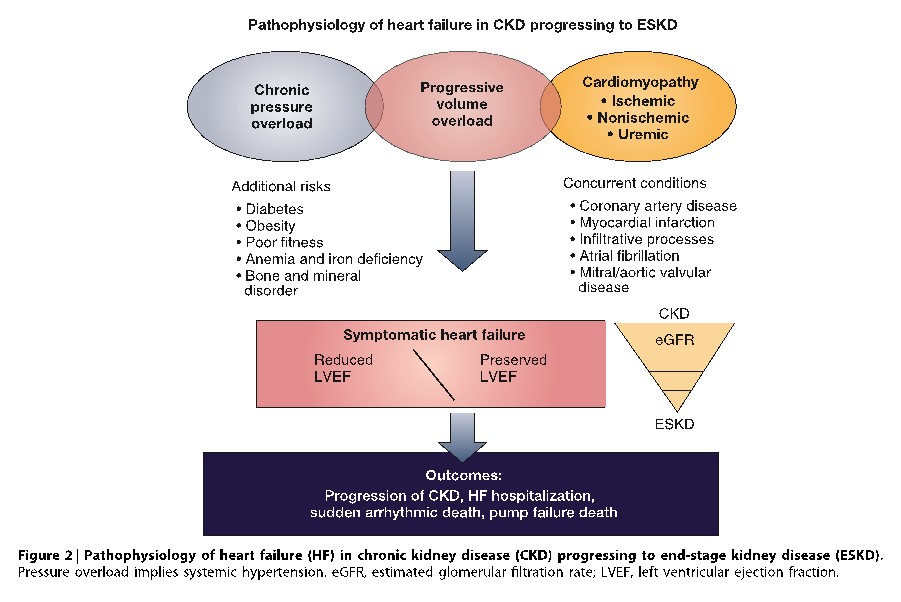
La incidencia de IC de novo en la ERC conocida varía entre el 17 y el 21%(4) y su aparición cambia según el estadio de ERC y la modalidad de tratamiento sustitutivo renal, incluido el trasplante renal (TxR) (figura 1). La reducción del FGe se asocia con mayor riesgo de mortalidad de cualquier causa, mortalidad cardiovascular y hospitalización en pacientes con IC-FEp o IC-FEr.(5,6) Considerando que en la medida que aumenta la gravedad de la ERC, también lo hace la prevalencia de IC, se estima que 44% de los pacientes en hemodiálisis (HD) tienen IC (10% con- IC-FEp, 13% con IC-FEr y 21% con IC-FEm).(7) La fisiopatología es compleja y en forma integrada se muestra en la figura 2. El 20 al 57% de los pacientes con IC crónica (ICC) tienen ERC; de los pacientes con IC hospitalizados, el 25 al 33% tienen falla renal aguda, el FGe es un predictor de mortalidad en pacientes con IC y el 20 al 30% de los pacientes con IC tienen resistencia al tratamiento diurético. (8, 10)
TRATAMIENTO:
Las recomendaciones para el manejo de pacientes con IC y ERC concomitante no difieren, en general, de las de los pacientes con FGe normal.(2) Hay que considerar que los pacientes con ERC grave (FGe <30 ml/min/1,73 m2), han sido excluidos de la mayoría de los ensayos clínicos, sin embargo, en los escasos estudios disponibles, el beneficio observado en la mayoría de estos estudios fue similar, e incluso mayor, que en los pacientes con FGe entre 30-60 ml/min/1,73 m2. (9)
Los pacientes con ERC e IC se benefician con las medidas higiénico-dietéticas, tales como: disminución del consumo de sal, control de la hipertensión arterial (HTA) y la glicemia, tratamiento de la dislipidemia y ejercicio acorde a su capacidad.
ENFOQUE DEL TRATAMIENTO SEGÚN LA FUNCIÓN SISTOLICA DEL VENTRICULO IZQUIERDO (FSVI): Pacientes con ERC e IC-FEr: entre los medicamentos que pueden reducir los resultados adversos se incluyen los inhibidores de la enzima convertidora de angiotensina (IECA), antagonistas del receptor de angiotensina II (ARAII), antagonistas de receptor de angiotensina e inhibidores de neprilisina (ARNI), betabloqueantes (BB) y antagonistas de los receptores de mineralocorticoides (ARM) , (11,12) a los cuales se han agregado en los últimos años, las gliflozinas: empagliflozina (13) y dapagliflozina (14) ambas con end point primario de disminución significativa de la combinación de muerte cardiovascular u hospitalización por empeoramiento de la IC. En el estudio DAPA-HF se incluyeron pacientes con un FGe > 30ml/min/1,73m2 y se definió como empeoramiento de la función renal al compuesto de reducción del ≥50% del FGe durante al menos 28 días, enfermedad renal en etapa terminal o muerte por causas renales. La enfermedad renal en etapa terminal se definió como: FGe < 15 ml/min/1,73 m2 (≥28 días), diálisis a largo plazo (≥28 días) TxR. Se informaron eventos adversos graves de lesión renal aguda en 23 pacientes (1,0%) en el grupo de dapagliflozina y en 46 (1,9%) en el grupo de placebo (P = 0,007) (12) y en el estudio EMPEROR que incluye pacientes con FGe < 30ml/min/1,73m2 en tratamiento sustitutivo con diálisis crónica o TxR o incluso FGe < 15 ml/min/1,73 m2 ; la tasa de disminución del FGe durante el período de tratamiento doble ciego fue más lenta en el grupo de empagliflozina que en el grupo placebo (–0,55 ml/min/1,73 m2 por año frente a –2,28 ml/min/1,73 m2 por año, respectivamente), para una diferencia entre grupos de 1,73 ml/min/1,73 m2 por año (IC del 95%, 1,10 a 2,37; P <0,001), lo que nos da seguridad para el uso de estas medicaciones en estos pacientes. (13) No debemos olvidar los diuréticos de asa como parte del tratamiento, si la diuresis se encuentra conservada
En pacientes con ERC e IC-FEp: actualmente no contamos con estudios que nos demuestren impacto en la sobrevida y el tratamiento está enfocado en tratar las causas de la IC, como la HTA, diabetes mellitus (DM) , obesidad, arritmias, en mejorar el estilo de vida, además de realizar un seguimiento periódico.
TRATAMIENTO SEGÚN LA FUNCIÓN RENAL:
Terapéutica medica en pacientes con ERC, según FGe:
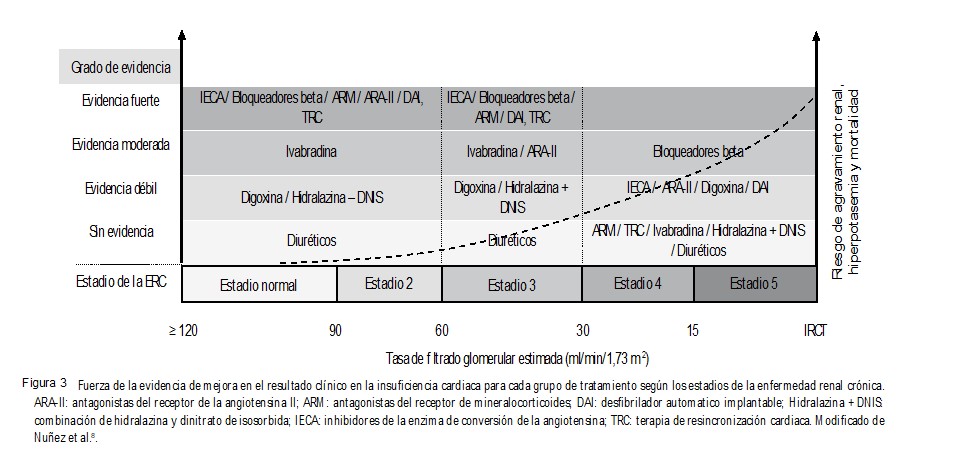
Según el grado de ERC y las evidencias de cada uno de los medicamentos, la propuesta de tratamiento se muestra en la Figura 3. (10)
En la figura 3 falta agregar los ARNI, la empaglifozina y la dapaglifozina, que deberán adaptarse en las recomendaciones según su nivel de evidencia, en especial en pacientes con FGe <30 ml/min/1,73m2. Deficiencia de hierro y anemia. Los agentes estimulantes de la eritropoyesis no tienen efecto sobre la prevención o el tratamiento de la IC en pacientes con ERC. (15, 16) Sin embargo, para los pacientes con IC crónica y deficiencia de hierro con o sin anemia, el tratamiento con carboximaltosa férrica endovenosa mejora los síntomas, la capacidad funcional y la calidad de vida. (17)
Considerando las terapias de sustitución renal:
Para hablar de ellas, primero hay que referirse al sindrome cardiorrenal (SCR), el cual se divide en:
Tipo I – IC aguda, conduce a una enfermedad renal aguda (ERA).
Tipo II – ICC causa deterioro progresivo de la función renal conduciendo a ERC.
Tipo III – ERA o ERC reagudizada conduce a IC aguda.
Tipo IV – La ERC avanzada causa ICC.
Estos últimos dos tipos de SCR serán abordados en este documento.
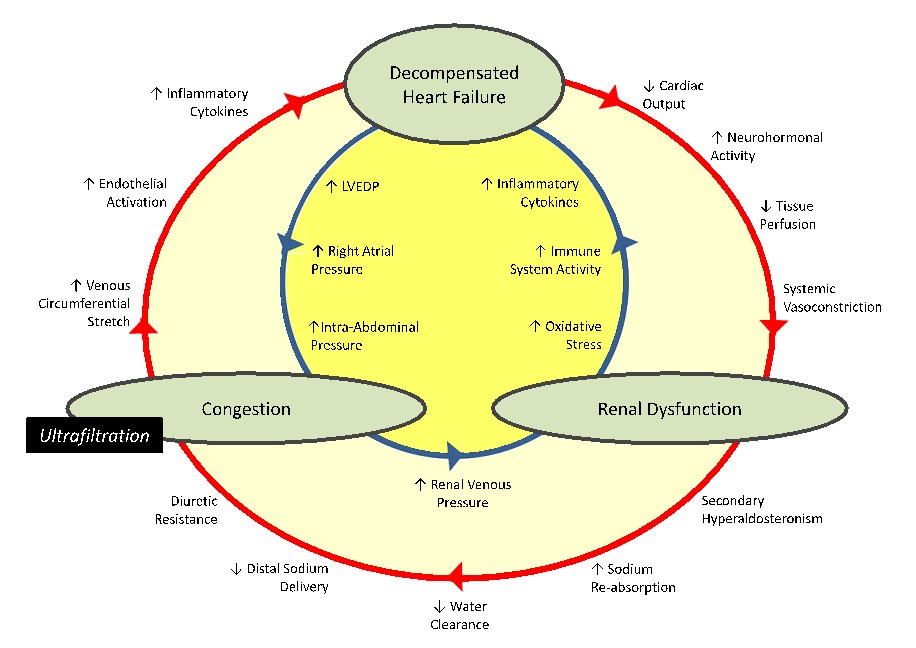
SCR tipo III, en este grupo de pacientes está indicada la diálisis para realizar ultrafiltración (UF), debido a que la IC aguda puede conducir al deterioro del FGe a través de la actividad neurohormonal exacerbada (es decir, bajo flujo hacia adelante) o sobrecarga de líquidos y congestión venosa renal (es decir, alta presión hacia atrás). La UF podría contrarrestar estas interacciones desadaptativas principalmente a través de la corrección de la congestión. Figura 4.(18)
Debemos considerar que quienes más necesitan UF son los pacientes hemodinámicamente inestables y con IC-FEr <40%. Su peor tolerancia a este tratamiento se debe a que muestran un bajo gasto cardiaco, elevada actividad neurohormonal, aumento de la actividad del sistema renina angiotensina aldosterona, disminución de la perfusión tisular y a un proceso inflamatorio secundario a la respuesta inflamatoria sistémica, lo que genera un círculo vicioso que nos lleva a deterioro del FGe, empeoramiento de la IC y congestión, que puede ser detenido mediante la UF.
Aquellos pacientes con IC-FEp, por lo general tienen una buena tolerancia a este tratamiento.
SCR Tipo IV . En este grupo también esta indicada la UF y debemos considerar que los pacientes que más necesitan UF son los que poseen IC-FEr, pero son los que peor tolerancia tienen a este tratamiento, por lo que debemos tomar las medidas necesarias para evitar complicaciones, al contrario, los pacientes con IC-FEp, en general, tienen una buena tolerancia a este tratamiento.
En estos 2 tipos de SCR hay que considerar que, si el paciente aún posee una respuesta diurética, existe la posibilidad del tratamiento con diuréticos de asa, en especial en aquellos centros, donde no se cuenta con la experiencia necesaria para realizar la UF o no se podrá realizar con la celeridad necesaria.
En pacientes con ERC e IC-FEr existe la posibilidad de la diálisis peritoneal (PD) como alternativa a la hemodiálisis (HD), la cual es menos agresiva, más fisiológica y se puede realizar en el hogar.
Aumentar la frecuencia de las sesiones de diálisis, como HD diaria de corta duración, reduce la masa del VI, el riesgo de muerte cardiovascular y hospitalizaciones. Los pacientes en diálisis domiciliaria, HD y/o PD, tienen un menor riesgo de hospitalización por IC y mortalidad cardiovascular (menos riesgo de IC, sobrecarga de líquidos y miocardiopatía). (19) Hasta el momento, no hay estudios que demuestren superioridad de la PD sobre la HD. Son deseables estrategias para mantener, cuando sea posible, la función renal residual, ya que esto puede mitigar algunos de los cambios hemodinámicos y de líquidos importantes que ocurren con la eliminación de volumen durante la diálisis. (9) TRASPLANTE DE RIÑON En pacientes en plan de TxR, la IC se ha identificado con mayor frecuencia en las bases de datos clínicos y con menos frecuencia en estudios como la ecocardiografía. Los datos sobre la prevalencia y el pronóstico de la IC antes del TxR son escasos, pero la prevalencia de DSVI en los pacientes en lista de espera para un TxR puede llegar al 25%. El TxR se asocia con un mayor riesgo de mortalidad, eventos cardiovasculares y falla del injerto. Sobre la base de los datos de facturación de Medicare, la incidencia de IC de novo posterior al TxR es del 18% a los 3 años. (9) Diagnóstico y cribado de la IC en receptores de trasplante renal Hay poca evidencia de si se debe realizar un ecocardiograma para evaluar la FSVI en todos los candidatos a TxR, sin embargo, es razonable obtener un ecocardiograma si hay síntomas de IC, antecedentes de enfermedad cardiovascular, pacientes con DM o inestabilidad hemodinámica en diálisis. El abordaje de la IC de novo en los receptores de TxR es el mismo que el de la población general, incluida la evaluación de la enfermedad. (9) Tratamiento de la IC en receptores de trasplante renal Los receptores de TxR con IC deben ser tratados en forma semejante a la población general. No se han realizado estudios de intervención definitivos de IECA o ARA II, ARM, BB, bloqueantes de los canales de calcio, nitratos, vasodilatadores o ARNI en el tratamiento de la IC en receptores de TxR. En un pequeño estudio de receptores de TxR con hipertrofia del VI, lisinopril redujo el índice de masa del VI en comparación con placebo (20). No hay informes que evalúen intervenciones que podrían prevenir o retrasar el desarrollo de IC de novo en pacientes con TxR, ni existen ensayos en pacientes con TxR que hayan incluido la IC como criterio de valoración. (9) Se ha descrito reversión clínica y mejoría de la función sistólica del VI después de un TxR, apoyando la idea de una probable cardiomiopatía urémica reversible. (reversión menos probable en pacientes en diálisis), por ello no deberíamos excluir a los candidatos a TxR en función a su FSVI. (21,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,38) En aquellos pacientes con ERC en HD con IC-FEr, se observó mayor sobrevida en aquellos pacientes sometidos a trasplante cardiaco-renal vs aquellos que recibieron trasplante cardiaco (75% vs 51%).(39)
Conclusiones:
El enfoque para el manejo de los pacientes con ERC e IC debe ser multidisciplinario, considerando las múltiples causas y comorbilidades de ambas patologías.
En los pacientes con ERC e IC, con o sin deterioro de la FSVI se debe realizar un estricto manejo de sus comorbilidades, cambios en el estilo de vida y medidas higiénico-dietéticas, como disminución del consumo de sal, tratamiento de la HTA, DM tipo2, dislipidemia, ejercicio regular y dieta acorde a su patología.
Los pacientes con ERC e IC, deben iniciar tratamiento con medicamentos específicos para IC, en especial en aquellos pacientes con IC-FEr y en los pacientes con IC-FEp debemos más bien enfocarnos en tratar los factores de riesgo cardiovascular, comorbilidades y sintomatología.
Los pacientes con IC-FEr y ERC presentan buena respuesta al tratamiento con empaglifozina y dapaglifozina, aún en casos con FGe reducido, motivo por el cual constituyen una opción terapéutica viable en este grupo de pacientes.
En pacientes con SCR tipo III y tipo IV, el tratamiento sustitutivo renal con UF, ayuda a mejorar la clínica del paciente y disminuye rehospitalizaciones por IC.
La DP es una opción para la UF en los pacientes con ERC e IC.
El TxR es una terapia que puede ser considerada en pacientes con ERC e IC y debemos considerarla aun en casos de FSVI deteriorada.
En pacientes con ERC en HD y en plan de trasplante cardiaco, se observa mayor sobrevida en aquellos en los que se realizó un trasplante cardiorrenal.
Bibliografía:
1.Andrew A. House, Christoph Wanner. Et al. Heart failure in chronic kidney disease: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney International (2019) 95, 1304–1317.
2.Piotr Ponikowski, , Adriaan A. Voors. Et al. Guía ESC 2016 sobre el diagnóstico y tratamiento de la insuficiencia cardiaca aguda y crónica. DOI: 10.1016/j.recesp.2016.10.014.
3.Kydney Disease: Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 clinical practice for the evaluation management of chronic kidney disease. Kidney Int Supp. 2013;3;1-150.
4.Kottgen A, Russell SD, Loehr LR, et al. Reduced kidney function as a risk factor for incident heart failure: the Atherosclerosis Risk in Communities (ARIC) study. J Am Soc Nephrol. 2007;18:1307–1315.
5.Hillege HL, Nitsch D, Pfeffer MA, et al. Renal function as a predictor of outcome in a broad spectrum of patients with heart failure. Circulation. 2006;113:671–678.
6.Lofman I, Szummer K, Dahlstrom U, et al. Associations with and prognostic impact of chronic kidney disease in heart failure with preserved, mid-range, and reduced ejection fraction. Eur J Heart Fail. 2017;19:1606–1614.
7.United States Renal Data System. Annual Data Report 2016: Chapter 9: cardiovascular disease in patients with ESRD. Available at: https://www. usrds.org/2016/view/v2_09.aspx-zoom_highlight1⁄4dialysis heart failure. Accessed April 7, 2019.
8.Ronco et al. J Am Coll Cardiol 2012;60: 1031-42.
9.Damman K, Tang WH, Felker GM, et al. Current evidence on treatment of patients with chronic systolic heart failure and renal insufficiency: practical considerations from published data. J Am Coll Cardiol. 2014;63:853-871.
10.L.. Górriz et al. Tratamiento de la insuficiencia cardiaca en el paciente con insuficiencia renal avanzada / Rev Esp Cardiol Supl. 2019;18(B):31-39
11.Cleland JG, Tendera M, Adamus J, et al. The Perindopril in Elderly People with Chronic Heart Failure (PEP-CHF) study. Eur Heart J. 2006;27: 2338–2345.
12.Pitt B, Pfeffer MA, Assmann SF, et al. Spironolactone for heart failure with preserved ejection fraction. N Engl J Med. 2014;370:1383–1392.
13.Packer, S.D. Anker, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. n engl j med 383;15 nejm.org October 8, 2020
14.J.V. McMurray, S.D. Solomon, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. This article was published on September 19, 2019, at NEJM.org. DOI: 10.1056/NEJMoa1911303
15.Rossignol P, Zannad F, Pitt B, et al. Time to retrieve the best benefits from renin angiotensin aldosterone system (RAAS) inhibition in heart failure patients with reduced ejection fraction: lessons from randomized controlled trials and registries. Int J Cardiol. 2014;177:731–733.
16.Pfeffer MA, Burdmann EA, Chen CY, et al. A trial of darbepoetin alfa in type 2 diabetes and chronic kidney disease. N Engl J Med. 2009;361: 2019–2032.
17.Anker SD, Comin Colet J, Filippatos G, et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med. 2009;361: 2436–2448.
18.Amir Kazory. Ultrafiltration Therapy for Heart Failure: Balancing Likely Benefits against Possible Risks. CJASN August 2016, 11 (8) 1463-1471; DOI: https://doi.org/10.2215/CJN.13461215.
19.McCullough PA, Chan CT, Weinhandl ED, et al. Intensive hemodialysis, left ventricular hypertrophy, and cardiovascular disease. Am J Kidney Dis. 2016;68(5S1):S5–S14.
20.Paoletti E, Cassottana P, Amidone M, et al. ACE inhibitors and persistent left ventricular hypertrophy after renal transplantation: a randomized clinical trial. Am J Kidney Dis. 2007;50:133–142.
21.Katz SD, Parikh CR. Reverse left ventricular remodeling after kidney transplantation: unraveling the complex autointoxication of uremia. J Am Coll Cardiol. 2015;66:1788–1790.
22.Wali RK, Wang GS, Gottlieb SS, et al. Effect of kidney transplantation on left ventricular systolic dysfunction and congestive heart failure in patients with end-stage renal disease. J Am Coll Cardiol. 2005;45:1051–1060.
23.Hawwa N, Shrestha K, Hammadah M, et al. Reverse remodeling and prognosis following kidney transplantation in contemporary patients with cardiac dysfunction. J Am Coll Cardiol. 2015;66:1779–1787.
24.Parfrey PS, Harnett JD, Foley RN, et al. Impact of renal transplantation on uremic cardiomyopathy. Transplantation. 1995;60:908–914.
25.Patel RK, Mark PB, Johnston N, et al. Renal transplantation is not associated with regression of left ventricular hypertrophy: a magnetic resonance study. Clin J Am Soc Nephrol. 2008;3:1807–1811.
26.Lai KN, Barnden L, Mathew TH. Effect of renal transplantation on left ventricular function in hemodialysis patients. Clin Nephrol. 1982;18:74–78. 119.
27.Fleming SJ, Caplin JL, Banim SO, et al. Improved cardiac function after renal transplantation. Postgrad Med J. 1985;61:525–528.
28.Van Den Broek JH, Boxall JA, Thomson NM. Improved left ventricular function after renal transplantation. Med J Aust. 1991;154:279–280.
29.Abouna GM, Kumar MS, Silva OS, et al. Reversal of myocardial dysfunction following renal transplantation. Transplant Proc. 1993;25:1034–1035.
30.Sahagun-Sanchez G, Espinola-Zavaleta N, Lafragua-Contreras M, et al.The effect of kidney transplant on cardiac function: an echocardiographic perspective. Echocardiography. 2001;18:457–462. 123.
31.Melchor JL, Espinoza R, Gracida C. Kidney transplantation in patients with ventricular ejection fraction less than 50 percent: features and posttransplant outcome. Transplant Proc. 2002;34:2539–2540. 124.
32.Oppert M, Schneider U, Bocksch W, et al. Improvement of left ventricular function and arterial blood pressure 1 year after simultaneous pancreas kidney transplantation. Transplant Proc. 2002;34: 2251–2252.
33.Dudziak M, Debska-Slizien A, Rutkowski B. Cardiovascular effects of successful renal transplantation: a 30-month study on left ventricular morphology, systolic and diastolic functions. Transplant Proc. 2005;37: 1039–1043.
34..Vaidya OU, House JA, Coggins TR, et al. Effect of renal transplantation for chronic renal disease on left ventricular mass. Am J Cardiol. 2012;110:254–257.
35.Burt RK, Gupta-Burt S, Suki WN, et al. Reversal of left ventricular dysfunction after renal transplantation. Ann Intern Med. 1989;111:635– 640.
36.Schaffer JM, Chiu P, Singh SK, et al. Heart and combined heart- kidney transplantation in patients with concomitant renal insufficiency and end-stage heart failure. Am J Transplant. 2014;14: 384–396.








































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados