La insuficiencia mitral (IM) representa una de las valvulopatías de mayor prevalencia, afecta a más de 2 millones de estadounidenses con expectativa de duplicarse para el 2030. 1 Se clasifica en primaria si el compromiso es intrínseco de la válvula (prolapso, agresión reumática) y secundaria o funcional si el mecanismo es ajeno a la misma.
La insuficiencia mitral (IM) representa una de las valvulopatías de mayor prevalencia, afecta a más de 2 millones de estadounidenses con expectativa de duplicarse para el 2030. 1
Se clasifica en primaria si el compromiso es intrínseco de la válvula (prolapso, agresión reumática) y secundaria o funcional si el mecanismo es ajeno a la misma.
En la IM secundaria, descripta típicamente en cardiopatías dilatadas o isquémicas, existe un incremento de las fuerzas de tracción (dilatación focal o global del ventrículo izquierdo [VI] asociado a desplazamiento de uno o ambos músculos papilares) y una reducción en las fuerzas de cierre (disminución de la contractilidad y sincronía ventricular).
Históricamente se ha hablado poco en la bibliografía de la IM funcional de aquellos pacientes con fibrilación auricular (FA) e insuficiencia cardíaca con fracción de eyección preservada (ICFEP). Sin embargo, su prevalencia no es despreciable, sus mecanismos causales se encuentran en incremento y el pronóstico no parece ser benigno. De esta entidad conocida como IM funcional auricular nos referiremos a continuación. 2
EPIDEMIOLOGÍA
La IM auricular suele darse en el contexto de dilatación auricular izquierda (AI) y ventrículo izquierdo normal. Situación muy frecuente en nuestra práctica diaria, pacientes con FA e ICFEP.
El 2% de la población mundial padece FA, con tendencia a aumentar dado una mayor expectativa de vida. 3 Alrededor de un 5% de los pacientes con FA presentan IM significativas.4,5 Por su lado, la ICFEP representa aproximadamente la mitad de los pacientes con IC y hasta el 20% de estos presentan IM significativa. 6,7
Abe Y, et al estudiaron por primera vez la evolución en el tiempo de estos pacientes. En un análisis retrospectivo de casi 300 pacientes con FA y fracción de eyección (Fey) preservada observaron un 8% de IM auricular. En el seguimiento, estos pacientes presentaron mayor tasa (HR: 4.0; IC 2,3-7 por cada grado de incremento de severidad de IM) de eventos cardiovasculares (muerte cardíaca, internación por insuficiencia cardíaca [ IC ] y cirugía valvular mitral o tricuspidea). 8 Si bien los resultados son alarmantes, no contamos al momento con evidencia de mayor jerarquía.
MECANISMOS FISIOPATOLÓGICOS
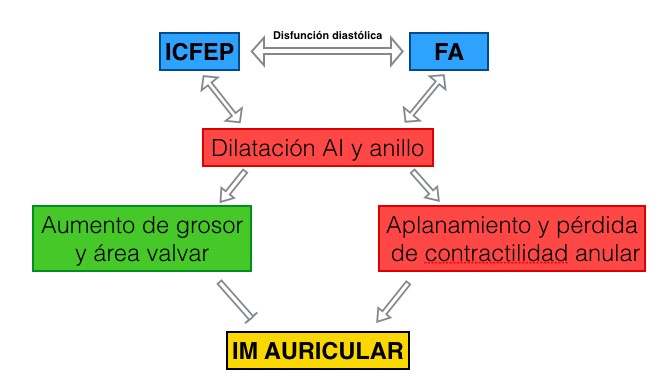
La FA y la ICFEP forman circuitos nocivos. La disfunción diastólica cursa con aumento de la presión en la AI que conlleva a dilatación y fibrosis de la misma. Esto conduce al desarrollo y mantenimiento de FA que finalmente genera IM. En sentido inverso, la FA contribuye a fibrosis del VI, disfunción diastólica, ICFEP y en consecuencia IM (Figura 1).
Figura 1. Fisiopatología de la IM auricular.
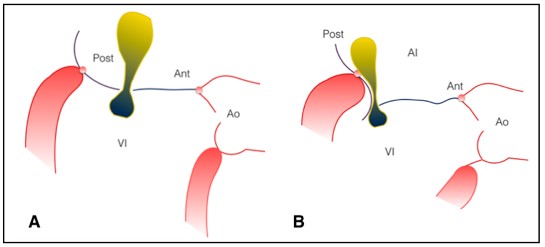
El anillo representa la porción más estrecha entre AI y VI, el área normal en mesosístole es de 4,9 ± 1 cm²/m² en hombres y de 4,5 ± 0,7 cm²/m² en mujeres. 16 Las valvas cubren por completo el anillo, su área es 1,5 a 2 veces mayor. Ante una dilatación leve a moderada del anillo secundaria a FA, la coaptación se mantiene a expensas de una reducción de la superficie de coaptación y una reducción de la altura de tenting. Cuando la dilatación anular se excede de los límites (anillo mayor a 8 cm²/m²) se genera reflujo.(Figura 2A).9,5
Se ha observado que las valvas tendrían cierta capacidad de adaptación. El estiramiento de la AI conduce a una diferenciación celular de un estirpe endotelial a mesenquimático que lleva a elongación y engrosamiento valvar. Cuando el crecimiento es insuficiente se origina insuficiencia (relación entre el área valvar y el área anular menor a 1,5). 5
El anillo mitral está compuesto por tejido fibroadiposo. No se contrae per se sino pasivamente con la contracción auricular y ventricular. Realiza tres movimientos durante el ciclo cardíaco. Uno de tipo esfinteriano por contracción anteroposterior; uno de pliegue sobre el eje intercomisural que acentúa la forma en silla de montar; y otro de traslación que acompaña al llenado y vaciamiento aurículo-ventricular. De esta forma se reduce un 30% hacia fin de diástole.11 Esta dinámica se altera en la FA y aún más asociado a IM.5
Otro mecanismo menos frecuente es el de tethering auricular de valva posterior. La porción posterior del anillo está implantada a la unión entre la Al y la pared libre del VI. Al crecer la AI desvía el implante del anillo y la valva en sentido posterior, originando un jet excéntrico en dirección a la misma (Figura 2B). 10
Figura 2. A. Dilatación anular y pérdida de coaptación valvar que origina escasa superficie de coaptación y como consecuencia un reflujo central. B. Tethering auricular de valva posterior que ocasiona insuficiencia con jet excéntrico homolateral.
En el ecocardiograma se observa un VI con geometría y fracción de eyección normal, en ocasiones una reducción del strain longitudinal global. Típicamente la AI y el anillo mitral están muy dilatados (diámetro anteroposterior mayor a 35 mm o relación de dicho diámetro y longitud diastólica de valva anterior mayor a 1,3.
El 3D tiene un rol muy importante. Las alteraciones del aparato valvular mitral no suelen ser simétricas y las asunciones realizadas en el 2D conlleva errores de interpretación y cuantificación.
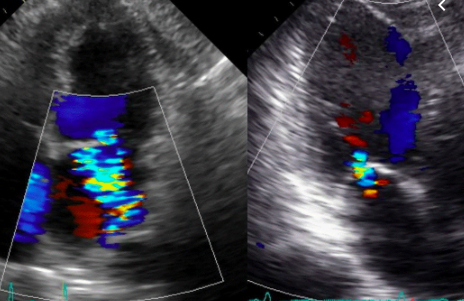
El grado de tethering ayuda a distinguir la causa auricular de la ventricular. Un estudio observó que para un mismo grado de dilatación anular, la altura y el volumen de tenting en la IM auricular (3.5 ±1.5 mm, 1.0 ± 0.7 mL respectivamente) fue significativamente menor que en la ventricular (8.1± 2.4 mm; 3.4 ± 1.6 mL respectivamente P<0,01). 17 (Video 1-2).
VIDEOS (1) Paciente femenina de 66 años, FA crónica. AI con dilatación severa, VI normal, IM moderada con jet central, escasa superficie de aposición valvar. (2) Reconstrucción tridimensional. Se mide área valvar total (AVT) diastólica 9,5 cm2/m2; área anular (AA) 7 cm2/m2; relación AVT/AA 1,3 (normal entre 1,5 y 2). Escaso tenting que pone en evidencia el aplanamiento del anillo (altura de tenting 0,6 cm, volumen de tenting 1 ml).
TRATAMIENTO
Las recomendaciones actuales sobre el manejo de la IM secundaria se refieren exclusivamente a la causa ventricular. 11
Sin embargo, no está esclarecido si las drogas que modulan el sistema neurohumoral son beneficiosas para reducir el remodelado de la AI, evitar la FA y consecuentemente la IM. Al momento no se demostró grandes beneficios en la población con ICFEP.
Es sabido que la FA crónica predispone al remodelado estructural y eléctrico de la AI. La estrategia de control de ritmo de la FA con cardioversión eléctrica o ablación ha demostrado reducir el tamaño de la AI, mejorar la deformación auricular y disminuir la severidad del reflujo.12,4 Este tratamiento debería instaurarse en una fase temprana de la enfermedad dado que la persistencia de la FA se vincula con menor tasa de éxito. 13
La anuloplastia quirúrgica parecería ser una opción adecuada si el mecanismo principal es la dilatación anular. Estudios con pocos pacientes han evidenciado buena evolución en el corto plazo. 14,15
Las distintas intervenciones percutáneas no han sido evaluadas en estos pacientes. Ante la creciente expansión de las mismas para el tratamiento de la IM secundaria ventricular es esperable que prontamente sean una opción válida para las atriales.
No obstante, debe priorizarse la restauración del ritmo sinusal antes de pensar en una opción de mayor complejidad.
CONCLUSIONES
La IM auricular es un tipo de IM secundaria con un mecanismo fisiopatológico único. Es una entidad sub-estudiada y reportada que ha empezado a llamar la atención de la comunidad científica dada la elevada prevalencia de sus principales agentes causales, la FA y la ICFEP asociado a un peor pronóstico de aquellos que la padecen. El remodelado auricular producido por estas entidades parecería ser el principal factor responsable, el cual se deberá pesquisar en los estudios por imágenes. La estrategia de control del ritmo parecería ser la que mejor costo beneficio les aporta a estos pacientes, sin embargo queda largo camino por recorrer tanto en el diagnóstico y tratamiento de esta enfermedad.
MENSAJES A DESTACAR
-La IM auricular ocurre principalmente en FA e ICFEP
-El mecanismo principal es la dilatación y pérdida de la mecánica del anillo mitral
-La detección del mecanismo implicado facilitará un tratamiento dirigido a la fisiopatología
Marcelo Izurieta1, Victor Darú2
1 Médico cardiólogo. Fellow de ecocardiografía – Sanatorio Finochietto.
2 Jefe del servicio de Ecocardiografía del Sanatorio Finochietto. Subjefe de Cardiodiagnóstico Investigaciones Médicas. Ex director del Consejo de Ecocardiografía – Sociedad Argentina de Cardiología.
BIBLIOGRAFÍA
1 Nkomo VT, Gardin JM, Skelton TN, Gottdiener JS, Scott CG, Enriquez-Sarano M. Burden of valvular heart diseases: a population based study. Lancet 2006;368:1005–11.
2 Deferm S, Bertrand PB, Verbrugge FH, et al. Atrial functional mitral regurgitation. J Am Coll Cardiol 2019;73:2465–76.
3 Chugh SS, Havmoeller R, Narayanan K, et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation 2014;129:837–47.
4 Gertz ZM, Raina A, Saghy L, et al. Evidence of atrial functional mitral regurgitation due to atrial fibrillation: reversal with arrhythmia control. J Am Coll Cardiol 2011;58:1474–81.
5 Kim DH, Heo R, Handschumacher MD, et al. Mitral valve adaptation to isolated annular dilation. Insights into the mechanism of atrial functional mitral regurgitation. J Am Coll Cardiol Img 2017;10:1–13.
6 Dunlay SM, Roger VL, Redfield MM. Epidemiology of heart failure with preserved ejection fraction. Nat Rev Cardiol 2017;14:591–602.
7 Kajimoto K, Sato N, Takano T. Functional mitral regurgitation at discharge and outcomes in patients hospitalized for acute decompensated heart failure with a preserved or reduced ejection fraction. Eur J Heart Fail 2016;18:1051–9.
8 Abe Y, Akamatsu K, Ito K, et al. Prevalence and prognostic significance of functional mitral and tricuspid regurgitation despite preserved left ventricular ejection fraction in atrial fibrillation patients. Circ J 2018;82:1451–8.
9 Kagiyama N, Hayashida A, Toki M, et al. Insufficient leaflet remodeling in patients with atrial fibrillation: association with the severity of mitral regurgitation. Circ Cardiovasc Imaging 2017; 10:005451.
10 Silbiger JJ. Does left atrial enlargement contribute to mitral leaflet tethering in patients with functional mitral regurgitation? Proposed role of atriogenic leaflet tethering. Echocardiography 2014;31:1310–1.
11 Nishimura RA, Otto CM. 2017 AHA/ACC focused update of the 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol 2017;70:252–89.
12 Dell’Era G, Rondano E, Franchi E, Marino PN. Atrial asynchrony and function before and after electrical cardioversion for persistent atrial fibrillation. Eur J Echocardiogr 2010;11:577–83.
13 Van Gelder IC, Crijns HJGM, Tieleman RG, et al. Chronic atrial fibrillation: success of serial cardioversion therapy and safety of oral anticoagulation. Arch Intern Med 1996;156: 2585–92.
14 Kihara T, Gillinov AM, Takasaki K, et al. Mitral regurgitation associated with mitral annular dilation in patients with lone atrial fibrillation: an echocardiographic study. Echocardiography 2009;26:885–9.
15 Takahashi Y, Abe Y, Sasaki Y, et al. Mitral valve repair for atrial functional mitral regurgitation in patients with chronic atrial fibrillation. Interact Cardiovasc Thorac Surg 2015;21:163–8.
16 Muraru D, Guta AC, Ochoa-Jimenez RC, et al. Functional Regurgitation of Atrioventricular Valves and Atrial Fibrillation: An Elusive Pathophysiological Link Deserving Further Attention. JASE, noviembre 2019.
17 Ring L, Dutka DP, Wells FC, Fynn SP, Shapiro LM, Rana BS. Mechanisms of atrial mitral regurgitation: insights using 3D transoesophageal echo. Eur Heart J Cardiovasc Imaging 2014;15:500-8.








































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados