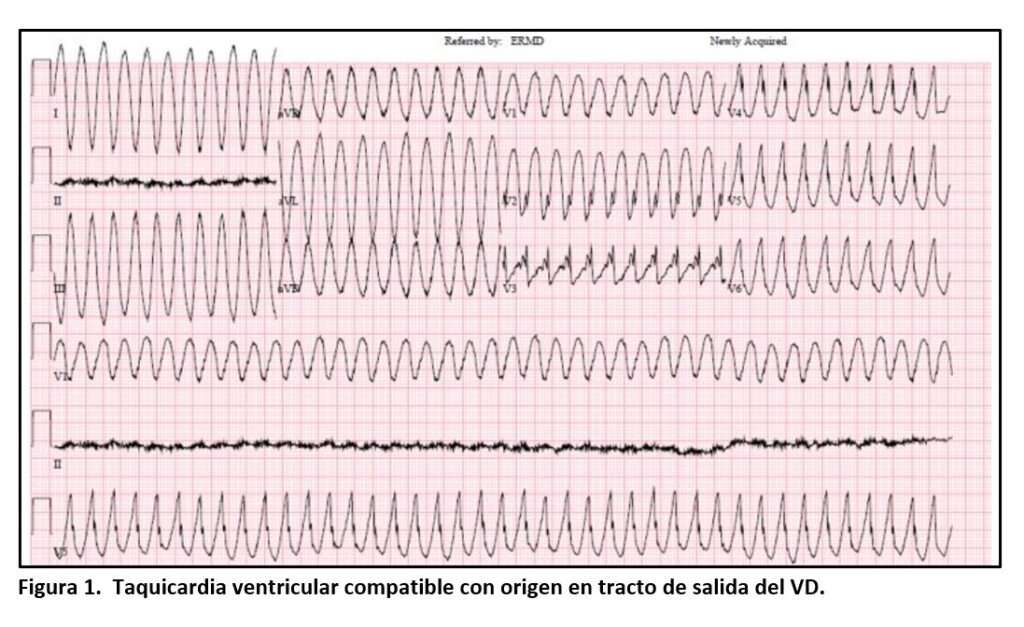
Revisión a partir de un Caso clínico Autores: Dra Ana Carolina Iribarren y Dr. Eugenio Cingolani Un paciente de 40 años de sexo masculino sin historia familiar relevante se presenta al departamento de emergencias con taquicardia ventricular (TV) sostenida (Fig. 1) requiriendo cardioversión eléctrica. Se realizaron estudios con angiotomografía coronaria no evidenciando enfermedad coronaria, ecocardiograma
Revisión a partir de un Caso clínico
Autores:
Dra Ana Carolina Iribarren y Dr. Eugenio Cingolani
Un paciente de 40 años de sexo masculino sin historia familiar relevante se presenta al departamento de emergencias con taquicardia ventricular (TV) sostenida (Fig. 1) requiriendo cardioversión eléctrica. Se realizaron estudios con angiotomografía coronaria no evidenciando enfermedad coronaria, ecocardiograma que informó fracción de eyección del ventrículo izquierdo (VI) del 50%, y una resonancia nuclear magnética (RMN) cardíaca que evidenció trastornos de motilidad parietal en VD con evidencia de disincronía, volumen de fin de diástole de VD ˃ 110 ml/m2, y realce tardío con gadolinio en el miocardio de VD. Con el cuadro clínico y los estudios presentados se realizó diagnóstico compatible con miocardiopatía arritmogénica y se decidió colocación de un cardiodesfibrilador implantable (CDI), otorgándose el alta hospitalaria a los 7 días de la internación con β-bloqueantes para continuar el seguimiento y estudios genéticos.
A los 10 días del alta, el paciente presenta palpitaciones seguido de choque del CDI. El interrogatorio del dispositivo reveló un choque apropiado por TV y se decidió aumentar la dosis de β-bloqueantes. Cuatro meses más tarde, presentó nuevamente un choque apropiado del CDI por TV a 240 latidos/min. El test genético demostró 3 mutaciones: dos en genes que codifican proteínas estructurales (desmoplaquina y junctofilina), y una tercera en el gen que codifica el receptor de rianodina; todas clasificadas como variantes de significado incierto, donde no se puede establecer claramente la contribución que tiene cada mutación en el fenotipo de la enfermedad.
La Miocardiopatía Arritmogénica (MA) es una enfermedad causada por una alteración genética, cuya presentación clínica es principalmente con arritmias, pero puede tener un amplio espectro, desde pacientes asintomáticos, hasta pacientes que se presenten con tormenta eléctrica con fibrilación ventricular, miocardiopatía biventricular y muerte súbita (MS) [1]. La mayoría de los casos son de origen familiar, con herencia autosómica dominante, causados por mutaciones en uno de los tantos genes que codifican las proteínas desmosomales [2]. Por lo tanto, se considera como una enfermedad del desmosoma. Sin embargo, y en menor frecuencia, también pueden existir otras mutaciones genéticas que se relacionan con los genes que codifican canales iónicos [3], como es el caso del paciente presentado.
Anteriormente se pensaba que este tipo de MA sólo comprometían al VD. En el año 1994 se establecieron los criterios diagnósticos para definir la miocardiopatía o displasia arritmogénica del VD (MAVD/DAVD), con criterios mayores y menores de diagnóstico que incluían alteraciones estructurales, histológicas, electrocardiográficas, arritmogénicas y factores genéticos [4]. El compromiso del VI se excluía de este diagnóstico, pero cuando se comenzaron a usar técnicas más sensibles como la RMN cardíaca, se observó que muchos de los pacientes con MAVD también presentaban compromiso del VI, por lo cual en el año 2010 se incluyó dentro del diagnóstico al compromiso del VI y se agregaron los hallazgos de la RMN a los criterios diagnósticos [5]. Dado que la afección puede ser del VD, del VI o biventricular, actualmente se prefiere la denominación miocardiopatía arritmogénica. Cuando predomina el origen en el VI, las arritmias ventriculares tienen morfología de rama derecha, en la RMN se evidencia realce tardío con gadolinio en el VI, principalmente a nivel subepicárdico/mesocárdico de la pared inferior o inferolateral, y se pueden asociar fenotipos cardíacos (ej. fibrilación auricular o trastornos de conducción) o sistémicos (ej. distrofia muscular o lipodistrofia) adicionales, y además de la arritmia del VI o biventricular, puede existir dilatación del VI con deterioro de la fracción de eyección del VI [6].
En la MA, a diferencia de otras miocardiopatías, la forma inicial de presentación es con arritmias, más que con insuficiencia cardíaca, y la sospecha diagnóstica se debe plantear en casos de: palpitaciones y/o síncope vinculado al esfuerzo, muerte súbita (MS), presencia de extrasístoles ventricular (EV) frecuentes (˃ 500/24hs) y/o TV con morfología de rama izquierda, en ausencia de otra enfermedad cardíaca estructural.
La evaluación inicial debe incluir:
Historia familiar: se debe evaluar la historia familiar de al menos 3 generaciones, focalizando en muertes prematuras, arritmias y trastornos de conducción, así como fenotipos asociados con enfermedades musculoesqueléticas en la familia.
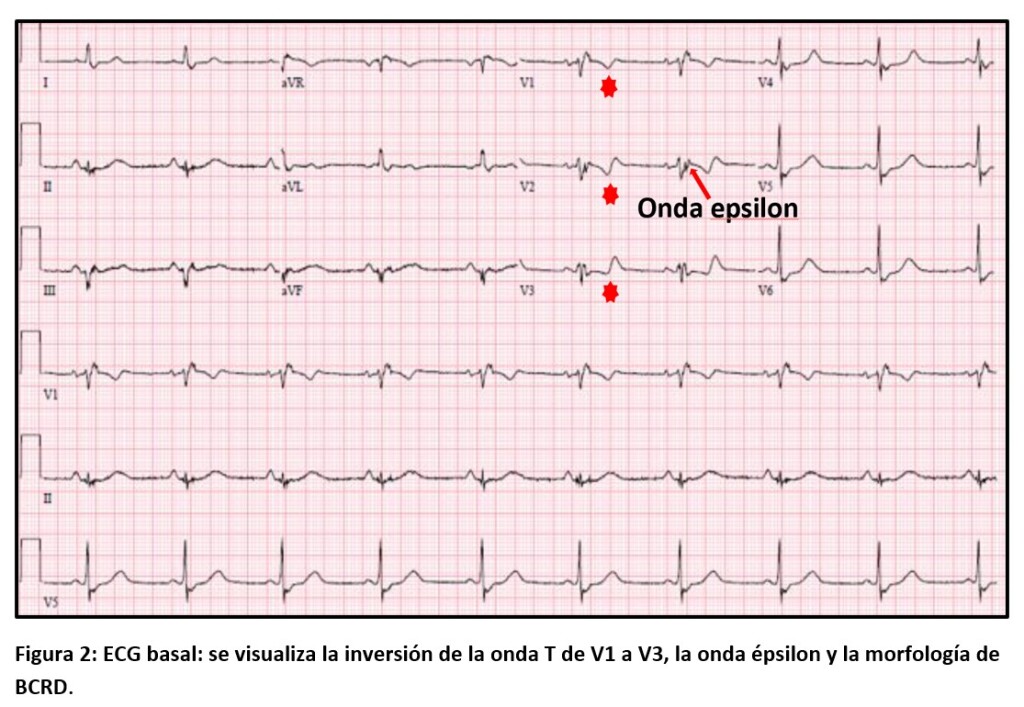
ECG de 12 derivaciones: más del 85% de los pacientes presentan alteraciones del ECG con ensanchamiento del QRS, bloqueo de rama e inversión de las ondas T, y raramente el ECG puede ser normal [7-9]. En mayores de 14 años, se considera un criterio diagnóstico mayor de MA a la inversión de las ondas T de V1 a V3 y como criterio menor cuando la inversión es de V1 a V4 y se asocia con BCRD. La presencia de T negativas en cara lateral y/o inferior sugiere compromiso del VI [10]. La onda Epsilon (definida como una deflexión de baja amplitud entre el fin del QRS y el inicio de la onda T, de V1 a V3) refleja las alteraciones de la conducción en el VD y el riesgo arrítmico a corto plazo, pero su capacidad diagnóstica es limitada ya que tiene baja sensibilidad/especificidad [11]. La prolongación desde el nadir de la onda S al final de la onda S ≥ 55 ms en V1, V2 o V3 ayuda a diferenciar MA de las TV del tracto de salida del VD.
Holter cardíaco: la presencia de más de 500 EV/24hs es un criterio diagnóstico menor de MA [12].
Ecodoppler cardíaco 2D: para la evaluación cuali y cuantitativa de la función y diámetros ventriculares, aunque tiene limitaciones para evaluar el VD. Es útil para evaluar trastornos de motilidad como aquinesia, disquinesia, aneurismas, medición del diámetro del tracto de salida del VD, la excursión sistólica del anillo tricuspideo, evaluar el diámetro basal del VD y para medir el strain longitudinal global, tanto del VI como del VD.
RMN cardíaca: evaluación de volúmenes y de la función global y regional ventricular. Los criterios diagnósticos mayores por resonancia son los trastornos de motilidad parietal regional del VD y el aumento del volumen de fin de diástole del VD (≥ 110 ml/m2 en hombres y ≥ 100 ml/m2 en mujeres), o la caída en la fracción de eyección ≤ 40%. Los criterios menores incluyen también trastornos de motilidad parietal regional del VD pero con menor aumento del volumen de fin de diástole del VD (≥ 100 ml/m2 en hombres y ≥ 90 ml/m2 en mujeres) [5]. Por RMN no hay un criterio diagnóstico que determine el compromiso del VI, pero si hay realce tardío con gadolinio, éste típicamente se presenta en el VI a nivel subepicárdico o mesocárdico y puede estar presente aún en ausencia de disfunción ventricular.
Nuestro paciente presentaba dos criterios diagnósticos mayores: alteraciones en la RMN cardíaca y la presencia de ondas épsilon en el ECG (Fig. 2); y dos criterios menores: TV del VD y la inversión de las ondas T de V1 a V3 con BCRD (Figs. 1 y 2).
Si con esta evaluación inicial no se llega a un diagnóstico entonces se pueden considerar otras pruebas diagnósticas:
Estudio electrofisiológico: tiene bajo valor predictivo tanto negativo como positivo para identificar riesgo de muerte súbita o arritmias ventriculares graves [13]. Puede ser útil en pacientes en los que se considere ablación por taquicardia ventricular refractaria, y para diferenciar de la taquicardia del tracto de salida del VD, en donde el estudio con altas dosis de isoproterenol puede ayudar a diferenciar pacientes con TV idiopática o EV de ARVC.
Biopsia endomiocárdica: puede ser muy útil para descartar otras causas de miocardiopatía como sarcoidosis o miocarditis, pero por su carácter invasivo, con baja sensibilidad/especificidad (dado el compromiso parcheado en la MA), tiene bajo rédito diagnóstico; y raramente se utiliza. La característica histológica es el reemplazo del tejido miocárdico por un tejido fibrograso.
Test genético: se debe realizar en aquellos pacientes que cumplen los criterios diagnósticos para MA de origen genético, y se deben interpretar por expertos en cardiopatías hereditarias. Un test genético positivo confirma el diagnóstico clínico (se considera un criterio diagnóstico mayor dentro de la historia familiar si hay evidencia de una mutación genética en algún miembro de la familia) y provee información para estratificar el riesgo y definir el tratamiento, así como decidir el testeo de los familiares. Existen varias mutaciones genéticas y en general hay poca asociación entre genotipo y fenotipo, con algunas excepciones: 1) la disfunción ventricular es más frecuente en pacientes con variantes patogénicas de LMNA, BAG3 o variantes en los genes PLN o TMEM43, seguido por DSP, DSG2/DSC2 [14]; 2) los pacientes que presentan múltiples variantes patogénicas tienen formas más severas de MA, con inicio de la enfermedad en edades más precoces [15] y presencia de TV, mayor riesgo de arritmias o MS a lo largo de su vida y progresión precoz a miocardiopatía [16]; 3) mutaciones de los genes que codifican los desmosomas (DSC2, DSG2, DSP, JUP, PKP2): la expresión clínica de la enfermedad se presenta entre los 20 y 50 años de edad, y es poco frecuente realizar diagnóstico más allá de los 60 años, la enfermedad presenta formas menos severas, son más frecuentemente asintomáticos, y las arritmias ocurren en presencia de alteraciones electrocardiográficas y cambios estructurales cardíacos [17]; 4) mutaciones de los genes que codifican Desmoplaquina (DSP): se asocian con síndromes cardiocutáneos, disfunción ventricular y en la RMN se pueden identificar patrones fibróticos extensos [18]; 5) Laminina A/C (LMNA): el fenotipo se caracteriza por presentar fibrilación auricular y trastornos de conducción que pueden preceder en décadas al desarrollo de arritmias ventriculares y miocardiopatía. Se puede presentar con compromiso del VD, VI o biventricular [19]; 6) proteína transmembrana 43 (TMEM43): se presenta en pacientes con MA del VD predominante, y en 43% de los pacientes se observó mala progresión de la onda R en precordiales y dilatación del VI [20]; 7) fosfolamban (PLN): generalmente los pacientes con esta variante tienen hipovoltaje en el ECG y se consideran de alto riesgo para arritmias ventriculares malignas e insuficiencia cardíaca con fracción de eyección menor 45% [21].
Las mutaciones evidenciadas en nuestro paciente se encontraron en los genes de desmoplaquina, junctofilina y de los receptores de rianodina (RYR2). RYR2 son una clase de canales intracelulares involucrados en el transporte de calcio en algunos tejidos excitables como el corazón, y la mutación de éstos resulta en exceso de calcio citosólico. La liberación repetitiva de calcio en el periodo diastólico puede producir post despolarizaciones tardías y promover arritmias ventriculares [23]. Las mutaciones en los genes de rianodina se pueden encontrar hasta en el 9% de los pacientes con MA [24].
En relación al Screening familiar, el último consenso de expertos del año 2019, indica realizar el test genético a familiares de primer grado de un paciente con diagnóstico confirmado de MA, cada 1-3 años, comenzando a los 10-12 años, junto con evaluación cardiovascular que incluya ECG de 12 derivaciones, holter cardíaco, e imágenes cardíacas [25]. Debido a la herencia autosómica dominante, los familiares de primer grado presentan 50% de riesgo de presentar MA, pero la penetrancia y la severidad de la enfermedad es típicamente menos severa que en el caso índice.
Una vez que se establece el diagnóstico, el objetivo primario del manejo es prevenir la MS que es la consecuencia más temida en la MA, por lo que el primer planteo terapéutico es la necesidad o no de implantar un CDI.
El último consenso establece claramente qué pacientes con MA se benefician de un CDI en prevención secundaria: historia de TV sostenida mal tolerada (IB) o MS reanimada (IB), síncope atribuible a arritmia ventricular o TV sostenida tolerada hemodinámicamente (IIa/B). También lo establece en asintomáticos: mutación genética confirmada (fosfolamban, FLNC, laminina A/C) con Fracción de eyección ˂ 45% (IIa/B o C) y pacientes con Fracción de eyección ≤ 35% en CF II/III y expectativa de vida mayor de 1 año (I/B) [25].
En cambio, en prevención primaria no estaba claro cómo determinar el riesgo arritmogénico de los pacientes con MA. En el año 2015 se propuso un algoritmo para decidir el implante de CDI en estos pacientes, pero esta recomendación era basada en opiniones de expertos [1]. En el año 2019, de un trabajo realizado en 18 centros de Europa y Estados Unidos, surgió un modelo de estratificación de riesgo de arritmia ventricular con 7 parámetros clínicos, simples y accesibles para el uso clínico (edad, sexo masculino, presencia de sincope reciente, presencia de TVNS, EV en holter de 24hs, ECG con inversión de onda T en cara anterior e inferior, fracción de eyección de VD) que permite estratificar los pacientes en alto, moderado y bajo riesgo y así ayudar al médico clínico a decidir sobre el implante de CDI en prevención primaria en este grupo de pacientes [26]. (link de acceso al score de riesgo: https://arvcrisk.com/).
En relación al tratamiento farmacológico de estos pacientes, el objetivo es evitar la dilatación ventricular y el deterioro de la función ventricular, controlar los síntomas de insuficiencia cardíaca, y prevenir y tratar las arritmias, y en este sentido los fármacos utilizados son los mismos que se utilizan en otras miocardiopatías (IECA y ARAII, beta bloqueantes, antagonistas de aldosterona, sacubitrilo/valsartan, ivabradina y vasodilatadores), así como también los antiarrítmicos (amiodarona evaluando posibles efectos adversos, sotalol en pacientes jóvenes, flecainida junto con sotalol o metoprolol en pacientes sin disfunción ventricular y con CDI con arritmia ventricular refractaria a otros tratamientos). En aquellos pacientes con TV recurrente, refractaria al tratamiento farmacológico, se puede considerar la ablación por radiofrecuencia.
Para el caso particular del paciente presentado, con una mutación en los canales de rianodina (RYR2) y extrapolando datos de estudios realizados en pacientes con TV polimorfa catecolaminérgica, existiría una implicancia terapéutica con el uso de flecainida, dado que dichos estudios han demostrado que dicho fármaco podría tener efectos “estabilizantes” sobre los canales de rianodina, lo cual se asociaría con reducción de los episodios de TV en estos pacientes [27].
Bibliografía:
[1] Corrado D, Wichter T, et al. Treatment of arrhythmogenic right ventricular cardiomyopathy/dysplasia: an international task force consensus statement. Eur Heart J 2015; 36: 3227–3237.
[2] Sen-Chowdhry S, Syrris P, McKenna WJ. Genetics of right ventricular cardiomyopathy, J Cardiovasc Electrophysiol, 2005, vol. 16 (pg. 927-935).
[3] Medeiros-Domingo A, Bhuiyan ZA, Tester DJ, Hofman N, Bikker H, et al.(2009) The RYR2-encoded ryanodine receptor/calcium release channel in patients diagnosed previously with either catecholaminergic polymorphic ventricular tachycardia or genotype negative, exercise-induced long QT syndrome: a comprehensive open reading frame mutational analysis. J Am Coll Cardiol 54: 2065-2074.
[4] McKenna WJ, Thiene G, Nava A, et al. Diagnosis of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Task Force of the Working Group Myocardial and Pericardial Disease of the European Society of Cardiology and of the Scientific Council on Cardiomyopathies of the International Society and Federation of Cardiology. Br Heart J 1994; 71: 215–218.
[5] Marcus FI, McKenna WJ, Sherrill D, et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed modification of the task force criteria. Circulation 2010; 121: 1533–1541.
[6] Sen-Chowdhry S, Syrris P, Prasad SK, et al. Left-dominant arrhythmogenic cardiomyopathy: an under-recognized clinical entity. J Am Coll Cardiol. 2008; 52:2175– 87.
[7] Jaoude SA, Leclercq JF, Coumel P. Progressive ECG changes in arrhythmogenic right ventricular disease. Evidence for an evolving disease. Eur Heart J 1996; 17:1717–1722.
[8] Nava A, Bauce B, Basso C, et al. Clinical profile and long-term follow-up of 37 families with arrhythmogenic right ventricular cardiomyopathy. J Am Coll Cardiol 2000; 36: 2226–2233.
[9] Te Riele AS, James CA, Bhonsale A, et al. Malignant arrhythmogenic right ventricular dysplasia/cardiomyopathy with a normal 12-lead electrocardiogram: a rare but underrecognized clinical entity. Heart Rhythm 2013; 10:1484–1491.
[10] Jain R, Dalal D, Daly A, et al. Electrocardiographic features of arrhythmogenic right ventricular dysplasia. Circulation 2009; 120:477–487.
[11] Platonov PG, Calkins H, Hauer RN, et al. High interobserver variability in the assessment of epsilon waves: implications for diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia. Heart Rhythm 2016; 13:208–216.
[12] Camm CF, Tichnell C, James CA, et al. Premature ventricular contraction variability in arrhythmogenic right ventricular dysplasia/cardiomyopathy. J Cardiovasc Electrophysiol 2015; 26:53–57.
[13] Corrado D, Calkins H, Link MS, et al. Prophylactic implantable defibrillator in patients with arrhythmogenic right ventricular cardiomyopathy/dysplasia and no prior ventricular fibrillation or sustained ventricular tachycardia. Circulation 2010; 122:1144– 1152.
[14] Lopez-Ayala JM, Gomez-Milanes I, Sanchez Munoz JJ, et al. Desmoplakin truncations and arrhythmogenic left ventricular cardiomyopathy: characterizing a phenotype. Europace 2014; 16:1838–1846.
[15] Xu T, Yang Z, Vatta M, et al. Compound and digenic heterozygosity contributes to arrhythmogenic right ventricular cardiomyopathy. J Am Coll Cardiol 2010; 55:587–597.
[16] Bhonsale A, Groeneweg JA, James CA, et al. Impact of genotype on clinical course in arrhythmogenic right ventricular dysplasia/cardiomyopathyassociated mutation carriers. Eur Heart J 2015; 36:847–855.
[17] Groeneweg JA, Bhonsale A, James CA, et al. Clinical presentation, long-term follow-up, and outcomes of 1001 arrhythmogenic right ventricular dysplasia/ cardiomyopathy patients and family members. Circ Cardiovasc Genet 2015; 8:437–446.
[18] Lopez-Ayala JM, Ortiz-Genga M, Gomez-Milanes I, et al. A mutation in the Zline Cypher/ZASP protein is associated with arrhythmogenic right ventricular cardiomyopathy. Clin Genet 2015; 88:172–176.
[19] Forleo C, Carmosino M, Resta N, et al. Clinical and functional characterization of a novel mutation in lamin a/c gene in a multigenerational family with arrhythmogenic cardiac laminopathy. PLoS One 2015;10: e0121723.
[20] Hodgkinson KA, Connors SP, Merner N, et al. The natural history of a genetic subtype of arrhythmogenic right ventricular cardiomyopathy caused by a p.S358L mutation in TMEM43. Clin Genet 2013; 83:321–331.
[21] Van Rijsingen IA, van der Zwaag PA, Groeneweg JA, et al. Outcome in phospholamban R14del carriers: results of a large multicentre cohort study. Circ Cardiovasc Genet 2014;7: 455–465.
[22] Van der Zwaag PA, Jongbloed JD, Van den Berg MP, Van der Smagt JJ, Jongbloed R, et al. (2009) A genetic variants database for arrhythmogenic right ventricular dysplasia/cardiomyopathy. Hum Mutat 30: 1278-1283.
[23] Lehnart SE, Wehrens XH, Kushnir A, Marks RA (2004) Cardiac ryanodine receptor function and regulation in heart disease. Ann N Y Acad Sci 1015: 144-159.
[24] Roux-Buisson N, Gandjbakhch E, Donal E, et al. Prevalence and significance of rare RYR2 variants in arrhythmogenic right ventricular cardiomyopathy/ dysplasia: Results of a systematic screening. Heart Rhythm 2014 Nov;11(11):1999-2009.
[25] Towbin J, McKenna WJ, et al. 2019 HRS expert consensus statement on evaluation, risk stratification, and management of arrhythmogenic cardiomyopathy. Heart Rhythm 2019 Nov; 16(11): e301-e372.
[26] Cadrin-Tourigny J, Bosman L, Nozza A et al. A new prediction model for ventricular arrhythmias in arrhythmogenic right ventricular miocardiopathy. Eur Heart J 2019 ; 40 :1850-1858.
[27] Van der Werf C, Kannankeril PJ, Sacher F, Krahn AD, Viskin S, et al. (2011) Flecainide therapy reduces exercise-induced ventricular arrhythmias in patients with catecholaminergic polymorphic ventricular tachycardia. J Am Coll Cardiol 57: 2244-2254.









































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados