Este artículo revisa los mecanismos fisiopatológicos, terapéuticos y pronósticos de los pacientes con ventrículo derecho disfuncionante e insuficiencia cardíaca con fracción de eyección preservada. Por muchos años el ventrículo derecho (VD) ha sido víctima del olvido otorgándole un rol central al ventrículo izquierdo (VI). Numerosos estudios han demostrado que la prevalencia en su deterioro es
Este artículo revisa los mecanismos fisiopatológicos, terapéuticos y pronósticos de los pacientes con ventrículo derecho disfuncionante e insuficiencia cardíaca con fracción de eyección preservada.
Por muchos años el ventrículo derecho (VD) ha sido víctima del olvido otorgándole un rol central al ventrículo izquierdo (VI). Numerosos estudios han demostrado que la prevalencia en su deterioro es alta, no solo en pacientes con deterioro de la función sistólica del VI en donde los mecanismos subyacentes son conocidos, por lo que su presencia contribuye a un peor pronóstico.
De la misma manera, en pacientes con insuficiencia cardíaca con fracción preservada (ICFp) la prevalencia es entre el 4% y el 50%, en parte por falta de consenso en su definición y la heterogeneidad de los registros. Es así que resulta útil realizar una revisión de los mecanismos fisiopatológicos, terapéuticas y pronósticos de los pacientes con ventrículo derecho deteriorado (VDD) e ICFp.
Fisiopatología
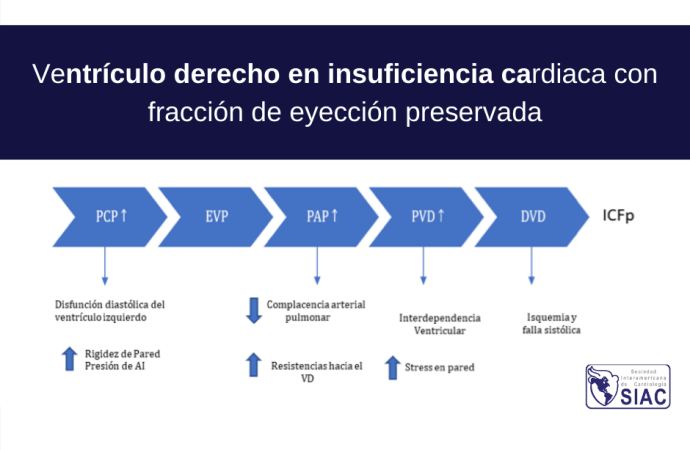
El VD posee paredes delgadas y alta complacencia, lo cual implica una cámara de baja presión, sometido en mayor magnitud que el ventrículo izquierdo a las limitaciones impuestas por el pericardio. De igual manera, ambos ventrículos se encuentran sujetos a cambios, de tal forma que existe una interdependencia ventricular, que juega un rol central en el correcto funcionamiento. Movimientos exagerados del septum generan cambios en ambas cavidades.
La disposición de sus fibras tiene un rol central en su funcionamiento, de esta manera, las fibras transversales que lo envuelven en la base proporcionan un 20% del gasto cardiaco, en cambio las fibras dispuestas en forma helicoidal regulan el resto.1,2
Los mecanismos de su disfunción han tratado de ser explicados a través de un mecanismo independiente de las condiciones de carga, en donde debido a las comorbilidades de los pacientes (enfermedad pulmonar crónica obstructiva [EPOC], hipertensión arterial, diabetes, obesidad) generan un estado proinflamatorio induciendo remodelado ventricular a través de disfunción endotelial. La extensión y el impacto aún no ha sido establecido.2,3
Por otro lado, el aumento de la poscarga tanto de forma aguda o en contexto crónico de hipertensión pulmonar (HTP) es el otro pilar fisiopatológico.
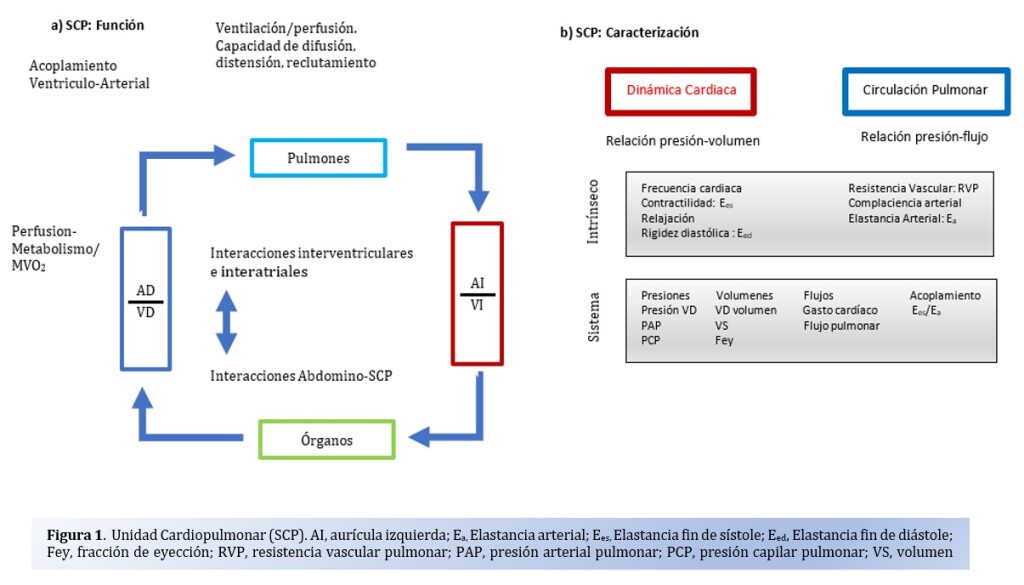
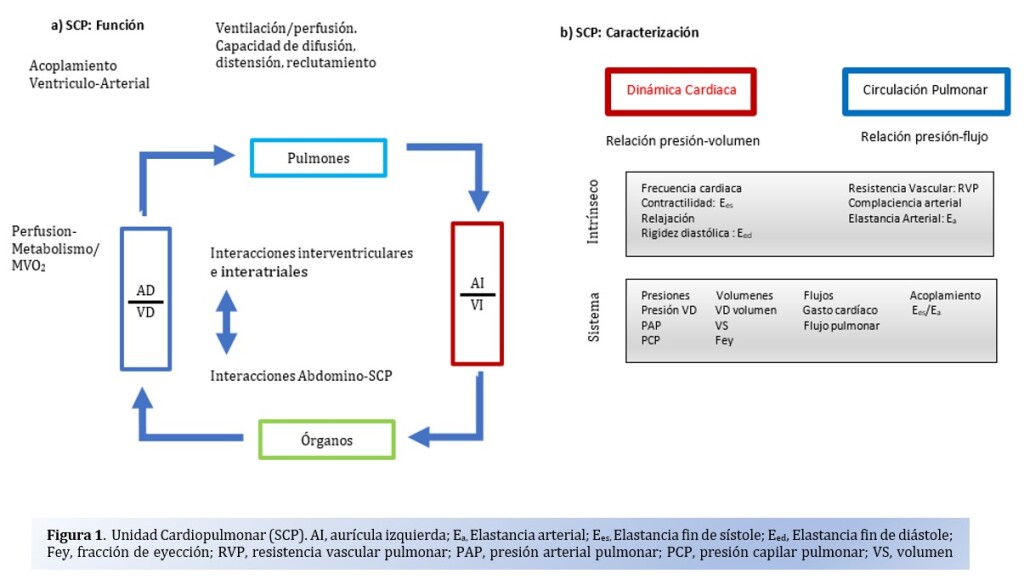
La asociación entre ICFp y HTP es bien conocida y se observa en 2/3 de los pacientes. Esta relación VD-HTP está intrínsecamente relacionados y forman una unidad cardiopulmonar compuestas a su vez por dos subsistemas, el VD y la vasculatura pulmonar. Ver figura 1. Esta interacción entre las características ventriculares y las condiciones de carga del VD descriptas como gasto cardiaco y fracción de eyección, por un lado, y un gradiente de presión y flujo del sistema arterial pulmonar ha sido estudiado, y es en base a esto que se han construido “loops Presion-Volumen (PV)” para describir este acoplamiento y transferencia de energía. Entonces, podemos conceptualizar el acoplamiento como la condición que ocurre cuando la función del VD se encuentra adaptada a la vasculatura pulmonar en donde la unidad cardiopulmonar funciona de manera eficiente.
Para poder evaluar la contractilidad intrínseca del VD de forma independiente de las condiciones de carga se ha utilizado la Elastancia a fin de sístole (Ees) y para la poscarga de la arteria pulmonar Elastancia arterial (Ea). Esta relación, Ees/Ea, cuando es 1 representa un acoplamiento ventrículo-arteria óptimo y cuando es entre 0.6 a 1 lo opuesto.3,
En condiciones normales, el loop PV del VD es de forma triangular, a consecuencia de un sistema de bajas presiones y alta complacencia del árbol arterial pulmonar en comparación con el circuito izquierdo. El ventrículo es capaz de adaptarse a cambios en las condiciones de carga, de esta forma al aumentar la poscarga es capaz de aumentar por 5 veces su contractilidad para lograr mantener una relación de elastancias de 1 (acoplamiento Ventrículo arterial). Este cambio genera un cambio de la morfología del loop a una forma rectangular y desviación hacia la izquierda. A medida que progresa la disfunción, la relación empieza a ser <1 con una reducción de la Ees y el desacople.5 Ver Figura 2.
Evaluación de la disfunción
La verdadera prevalencia en pacientes con ICFp es difícil establecer, por un lado, por la falta de estandarización y por el otro lado, el reto que conlleva medir su función.
Muchos parámetros se han utilizado y de diversos métodos de imagen. En la ecocardiografía se usa el área fraccional de acortamiento, la excursión del anillo tricúspide (TAPSE), la onda S del doppler tisular y el índice de perfomance miocárdico. Las guías actuales recomiendan usar por lo menos uno de estos parámetros.6
Ver Tabla 1.
Los cálculos de los volúmenes ventriculares a través de mediciones lineales también se dificultan al asumir al ventrículo con una estructura fija. Normalmente suele ser en forma de media luna que cambia cuando se sobrecarga de volumen a una forma símil elipsoide. Un campo en donde la forma de este no se ve tan afectada es la ecocardiografía 3D, se halla asociada con menor sobreestimación de los volúmenes. En vista a lo anterior, el cálculo de la fracción de eyección se dificulta y se ha establecido un punto de corte de <45% para el diagnóstico de disfunción.
A la fecha, el ecocardiograma ha jugado un rol central en la evaluación del VD, sin embargo, es un desafío en pacientes en los que las ventanas acústicas son subóptimas. Entonces, la resonancia magnética cobra un valor importante y se ha convertido en el gold standard para la medición de volúmenes. Además, la resonancia aporta la capacidad de caracterizar el tejido a través de secuencias de realce tardío, mapping T1 y cálculos de volúmenes extracelulares para poder estudiar otras causas secundarias de disfunción de VD. En los casos en que la resonancia no se pueda realizar se puede utilizar la tomografía cardiaca gatillada para estimar los volúmenes ventriculares.7
El ecocardiograma presenta un rol esencial en la evaluación de la presión sistólica pulmonar a través de la medición del jet de la velocidad de regurgitación tricúspide En un estudio de cohorte en pacientes con diagnóstico de ICFp, se observó que la prevalencia es alta (83%) lo que nos lleva a pensar que tal vez este infravalorada.
La contractilidad, propiedad intrínseca del miocardio, no es tan fácil de medir por métodos no invasivos ya que los mencionados previamente ( Fracción de eyección, FAC, TAPSE, onda S) son dependientes de las condiciones de carga. El gold standard para su medición es la realización de loops de P-V. Sin embargo, su uso se halla limitado en la práctica diaria.
Tratamiento
La alta prevalencia de deterioro del VD y las consecuencias pronósticas en pacientes con ICFp apoyan al desarrollo de tratamientos en estos pacientes. Las primeras estrategias de interés son una reducción de las presiones capilares pulmonares como mecanismo de poscarga elevada a través diuréticos en congestión o utilizando vías fisiológicas a través del oxido nítrico, guanilato ciclasa o caminos de la endotelina.
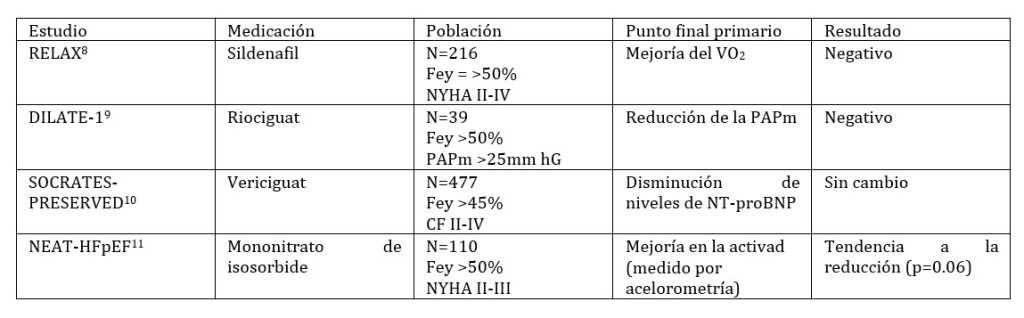
El estudio RELAX, en donde se estudio a 216 pacientes con IC con fracción de eyección <50% y clase funcional (CF II, III) y se les dio sildenafil no demostró mejoría del pico de consumo de oxígeno ni mejoría de la capacidad funcional.8
Los inhibidores del guanilato ciclasa, riociguat y vericiguat en el estudio DILATE-1, riociguat no demostró efecto agudo en la presión media pulmonar, sin embargo, tuvo efectos favorables en volumen sistólico e índice cardiaco.9 En el estudio SOCRATES-PRESERVED, vericiguat aumentó la calidad de vida, pero no cumplió su punto final primario de disminuir el tamaño auricular o los niveles de péptido natriurético atrial al compararlo con placebo. 10
Se utilizaron los nitratos, en el estudio NEAT-HFpEF, en donde no solo no cumplió su punto final primario, sino que aumentó los niveles de péptido natriurético atrial.11
Como se menciono, los estudios hasta el momento han tenido resultados neutros y no hay consenso en el tratamiento de la HP en estos pacientes. Ver tabla 2.
Tabla 2. Estudios de medicación con el objetivo de mejorar la Hemodinamia pulmonar.
DILATE-1, Acute Hemodynamic Effects of Riociguat in patients with Pulmonary Hypertension associated with Diastolic Heart Failure; NEAT-HFpEF, Nitrate’s Effect on Activity Tolerance in Heart Failure with Preserved Ejection Fraction; Fey, fraccion de eyección ; NYHA, New York Heart Association; RELAX, Phosphodiesterase-5 Inhibition to Improve Clinical Status and Exercise Capacity in Heart Failure with Preserved Ejection Fraction; ; PAPm, presion arterial media;SOCRATES-PRESERVED, Soluble Guanylate Cyclase Stimulator in Heart Failure Patients With Preserved EF
Pronóstico
La disfunción del ventrículo derecho se asocia a peor pronóstico, con alta tasa de requerimiento de hospitalizaciones y mortalidad, independiente de la presencia de HTP.12 En un estudio prospectivo con ICFp y fracción de eyección <45%, la mortalidad anual fue de 12% comparada con un 5% con fracción de eyección conservada. En otro grupo de pacientes referido a cateterismo derecho, el período de sobrevida a los 2 años fue de 56% para los que presentaban falla de la función del VD comparado a un 96- 93% que no lo presentaban. De manera similar, un TAPSE disminuido se asoció a un incremento de la mortalidad en 26%.1
El desacople VD-PA medido por la relación TAPSE:PSAP fue un fuerte predictor de eventos de mortalidad por todas las causas, independientemente de la severidad de la IC.13
Conclusión
La disfunción del ventrículo derecho es frecuente en pacientes con ICFp y los mecanismos fisiopatológicos son multifactoriales, pero cuando está presente, el pronóstico empeora. Con las técnicas multimágenes se ha facilitado reconocerlo, sin embargo, el tratamiento a través de un mecanismo de reducción de poscarga ha resultado poco útil por lo que hasta ahora es necesario la necesidad de nuevas terapias para esta entidad que no es del todo infrecuente en estos pacientes.
Ver link AQUI
Bibliografía
1)Berglund F, Piña P, Herrera CJ. Right ventricle in heart failure with preserved ejection fraction. 2020 Sep 7:heartjnl-2020-317342.
2)Gorter TM, van Veldhuisen DJ, Bauersachs J, et al. Right heart dysfunction and failure in heart failure with preserved ejection fraction: mechanisms and management. position statement on behalf of the heart failure association of the European Society of cardiology. Eur J Heart Fail 2018;20:16–37
3)Vonk Noordegraaf A, Westerhof BE, Westerhof N. The Relationship Between the Right Ventricle and its Load in Pulmonary Hypertension. J Am Coll Cardiol 2017;69:236–43.
4)Vonk Noordegraaf A, Chin KM, Haddad F, Hassoun PM, Hemnes AR, Hopkins SR, et al. Pathophysiology of the right ventricle and of the pulmonary circulation in pulmonary hypertension: an update. Eur Respir J. 2019;53(1):1801900
5)Borlaug BA, Kane GC, Melenovsky V, et al. Abnormal right ventricular-pulmonary artery coupling with exercise in heart failure with preserved ejection fraction. Eur Heart J 2016;37:3293.2–302
6)Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, Ernande L, Flachskampf FA, Foster E, Goldstein SA, Kuznetsova T, Lancellotti P, Muraru D, Picard MH, Rietzschel ER, Rudski L, Spencer KT, Tsang W, Voigt JU. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2015;16:233–270
7)Aschauer S, Kammerlander AA, Zotter-Tufaro C, et al. The right heart in heart failure with preserved ejection fraction: insights from cardiac magnetic resonance imaging and invasive haemodynamics: the right heart in heart failure with preserved ejection fraction. Eur J Heart Fail 2016;18:71–80.
8)Redfield MM, Anstrom KJ, Levine JA, et al. Isosorbide mononitrate in heart failure with preserved ejection fraction. N Engl J Med 2015;373:2314–24.
9)Bonderman D, Pretsch I, Steringer-Mascherbauer R, et al. Acute hemodynamic effects of riociguat in patients with pulmonary hypertension associated with diastolic heart failure (DILATE-1): a randomized, double-blind, placebo-controlled, single-dose study. Chest 2014;146:1274–85.
10)Pieske B, Maggioni AP, Lam CSP, et al. Vericiguat in patientS with worsening chronic heart failurE and preserved ejection fraction: results of the soluble guanylate cyclase stimulatoR in heart failurE patientS with preserved EF (SOCRATES-PRESERVED) study. Eur Heart J 2017;38:1119–27.
11)Mohammed SF, Hussain I, AbouEzzeddine OF, et al. Right ventricular function in heart failure with preserved ejection fraction: a community-based study. Circulation 2014;130:2310–20.
12)Zakeri R, Mohammed SF. Epidemiology of right ventricular dysfunction in heart failure with preserved ejection fraction. Curr Heart Fail Rep 2015;12:295–301.
13)Imad H, Mohammed Selma F, Forfia Paul R, et al. Impaired right Ventricular– Pulmonary arterial coupling and effect of sildenafil in heart failure with preserved ejection fraction. Circ Heart Fail 2016;9:e002729.










































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados