La tormenta eléctrica (TE) es una emergencia médica que se caracteriza por un estado de inestabilidad eléctrica miocárdica y la presencia de arritmias ventriculares (AV) sostenidas en un corto período de tiempo, la mayoría de veces definido como 24 horas (1). Cualquier AV puede hacer parte de este cuadro, pero la taquicardia ventricular (TV) monomórfica predomina, seguida de la TV polimórfica y la fibrilación ventricular (FV).
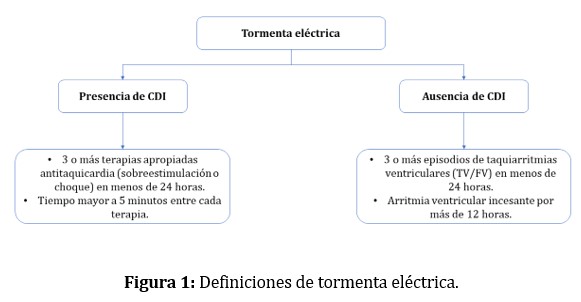
En pacientes sin cardiodesfibrilador implantable (CDI) se define TE como la presencia de 3 o más episodios interrumpidos de arritmias ventriculares durante 24 horas o arritmias ventriculares incesantes por más de 12 horas (2). En portadores de CDI, se considera TE cuando se presentan más de 3 terapias (descargas o estimulación antitaquicardia) apropiadas en menos de 24 horas con un tiempo mayor a 5 minutos entre cada terapia. Existe controversia respecto a estas definiciones pues dejan fuera pacientes cuyas AV van más lento que las zonas de detección de los CDI, aquellas que no son abortadas por las terapias, y aquellos en quienes los episodios de AV recurren menos de 5 minutos el uno del otro (Figura 1) (2-4).
Kowlgi y Cha presentaron en Europace una actualización con respecto al manejo contemporáneo de la TE pasando por la epidemiología, fisiopatología, estrategias farmacológicas, manejo intervencionista y perspectivas futuras (5).
Epidemiología:
La epidemiología de la TE es variable y depende de la definición utilizada, de la población incluida; es decir, cardiopatía isquémica (CMI) o no isquémica (CMNI), corazón estructuralmente enfermo o sano, portadores de CDI en prevención primaria o secundaria, entre otros.
Las poblaciones más susceptibles para presentar TE son hombres, edad avanzada, fracción de eyección del ventrículo izquierdo (FEVI) reducida, insuficiencia cardíaca (IC) en estadios más avanzados y condiciones comórbidas cardiovasculares de base (6).
En pacientes portadores de CDI en prevención secundaria, hasta el 10% a los 13 meses (7) y el 28% a los 33 meses de seguimiento pueden presentar TE (8). Un metaanálisis publicado por Guerra et al. encontró que la TE es una condición que incrementa hasta de 3 veces el riesgo de muerte, trasplante cardíaco y hospitalización por IC (9).
Fisiopatología:
Los pacientes con cardiopatía estructural constituyen la mayoría de los casos de TE. Pero aquellos con corazón estructuralmente sano y síndromes genéticos como el síndrome de Brugada (SdeB), síndrome de QT corto (SQTC), síndrome de QT largo (SQTL) y taquicardia ventricular polimórfica catecolaminérgica (TVPC) también pueden presentarse con esta condición (1, 10).
Kowlgi y Cha proponen en esta revisión una teoría de múltiples golpes que involucra 4 componentes principales (5) (Figura 2):
Sustrato anatómico: Tanto en pacientes con CMI y CMNI la presencia de cicatrices en el miocardio facilita la presencia de zonas con conducción heterogénea y con ello la formación de AV reentrantes (11).
Desencadenantes: Se reconocen como los principales la presencia de isquemia, falla cardíaca descompensada, alteraciones electrolíticas (en especial hipomagnesemia e hipopotasemia), alteraciones endocrinas, mala adherencia al manejo antiarrítmico. También se han reconocido como desencadenantes potenciales, alteraciones de la homeostasis del calcio intracelular, retroalimentación a la alta y a la baja de canales iónicos y anormalidades en la señalización intracelular a través de proteínas fosforiladas (5).
Disregulación autonómica: Algunas condiciones como la IC inducen un remodelado autonómico, favoreciendo el influjo simpático y disminuyendo el parasimpático (12). La presencia de choques a partir de los CDI genera un estado hiperadrenérgico, favoreciendo la presencia de AV y un círculo vicioso que perpetúa las mismas.
Factores adicionales: Los síndromes genéticos pueden proporcionar el sustrato eléctrico necesario para que se presente una TE (13). También la presencia de genes asociados con algunas canalopatías se ha encontrado en pacientes con condiciones como isquemia o IC.

Presentación clínica:
La presentación está determinada por factores como la frecuencia cardíaca (FC) de la arritmia, la función sistólica y la presencia o no de CDI. El síncope y la muerte súbita son más frecuente en aquellos con disfunción sistólica del VI (14).
Pacientes con AV más lentas (100 – 120 latidos por minuto) pueden presentarse con síntomas como palpitaciones, cefalea, mareo, debilidad o descompensación de la falla cardiaca (14).
Los portadores de CDI pueden estar incluso asintomáticos y haber tenido episodios abortados por estimulación antitaquicardia. Quienes han recibido varios choques pueden presentarse incluso con alteraciones psicológicas y comportamentales. En este grupo específico de pacientes que han recibido choques desde su dispositivo, siempre la primera pregunta consiste en determinar si esta descarga fue apropiada o no (para abortar una AV). Las descargas inapropiadas pueden presentarse hasta en el 40% de los portadores de CDI y las causas más frecuentes son arritmias supraventriculares rápidas, la sobredetección de las ondas T y disfunción de los electrodos (ruido, fractura o ruptura del aislante) (15).
La identificación de inestabilidad clínica, y rápida obtención e interpretación del electrocardiograma (ECG) son la piedra angular en el enfoque de estos pacientes; debe hacerse un análisis del ECG durante la arritmia y el ECG una vez resuelta buscando posibles causas como isquemia; siempre incluir una medición precisa del intervalo QT corregido. Posteriormente deben obtenerse todas las ayudas necesarias para buscar la presencia de desencadenantes como cuadro hemático, función renal, electrolitos, función hepática y cuando sea necesario gases arteriales, lactato y otros (5).
En condiciones en las que en el ECG sea una taquicardia de complejos anchos en un paciente con enfermedad cardiaca de base (anatómica, genética o funcional) siempre debe asumirse esta como TV y actuar en consecuencia.
Tratamiento (Figura 3):
Enfoque inicial: Determinar la estabilidad hemodinámica, en pacientes inestables o en parada cardíaca debe proporcionarse reanimación cardiopulmonar avanzada (16). En casos de AV (TV/FV) y ausencia de pulso debe desfibrilarse el paciente tan pronto como sea posible.
Simultáneamente identificar desencadenantes, corregirlos y en casos de isquemia aguda activar el laboratorio de hemodinámica.
Pacientes con comorbilidades cardiovasculares descompensadas, compromiso de órgano específico deben ser trasladados a unidades de alta dependencia, bien sea cuidados intensivos o cuidados cardiovasculares agudos según disponibilidad.
Evaluación del dispositivo y reprogramación: La revisión del dispositivo es de vital importancia, y lo primero será conocer si hay o no AV recurrentes, el tipo de arritmia y si las descargas han sido apropiadas o no. En caso de que sean inapropiadas las terapias deben ser suspendidas de inmediato. Donde no se disponga de un reprogramador, las terapias pueden inhabilitarse con la ayuda de un magneto (imán) de un tamaño suficiente que cubra la superficie del generador (1). Aún cuando han sido efectivas, con el fin de evitar choques recurrentes, pueden desactivarse temporalmente, siempre y cuando, el paciente esté estable y vaya a ser monitorizado estrechamente. Se sugiere además incrementar la frecuencia cardiaca de las zonas de detección y favorecer la estimulación antitaquicardia como terapia inicial (5).
En pacientes con alta estimulación del ventrículo derecho (VD) o en quienes recientemente se ha implantado un electrodo de resincronización en el VI, requieren programaciones especiales e incluso en ocasiones inactivación de la estimulación o estrategias para disminuirla pues en ocasiones estos pueden ser desencadenantes de AV (17).
Manejo farmacológico: Los medicamentos antiarrítmicos (MAA) son clave en el tratamiento de la TE y su aplicación debe ser considerada siempre como parte de las medidas iniciales.
En la tabla 1 se resumen las principales estrategias farmacológicas para el manejo de esta condición.


Sedación: En casos en lo que la TE sea refractaria al manejo inicial con medicamentos puede considerarse el manejo con sedación e intubación orotraqueal. La meta es disminuir el influjo simpático logrando un nivel en la Richmond Agitation-Sedation Scale (RASS) -2. Preferir opioides y benzodiazepinas con poco impacto cardiovascular, y evitar el Propofol por el efecto cronotrópico negativo (5).
Ablación con catéter: La ablación con catéter (AC) busca homogeneizar el tejido miocárdico cicatricial y con ello disminuir la formación de circuitos reentrantes. La AC está recomendada en pacientes que no responden al manejo médico o que no toleran el mismo. La AC es superior al manejo en cuanto a la recurrencia de AV, el número de descargas y algunos estudios retrospectivos sugieren un efecto en mortalidad que está por probarse de manera prospectiva (18). En pacientes con AV desencadenadas por contracciones ventriculares prematuras (CVP) la AC disminuye recurrencias y mortalidad.
En pacientes con recurrencia de AV luego de AC existen alternativas como la ablación intramural con aguja, la inyección retrograda de etanol en venas coronarias y el uso de ablación bipolar (1).
Modulación autonómica: Constituye una alternativa cuando los medicamentos y la sedación no han sido suficientes para controlar la arritmia. Las técnicas más frecuentes son anestesia epidural torácica (AET), bloqueo percutáneo del ganglio estrellado (BPGE) y la denervación simpática cardíaca (DSC) – abierta o por toracoscopia- (1).
La AET consiste en la aplicación de bupivacaina en el espacio epidural torácico. A través de un catéter epidural se administran 1 mL de bupivacaina seguido de infusión a 2 mL/h con dosis titulada según la respuesta (19).
El BPGE es una estrategia que se aplica al lado de la cama del paciente, consiste en la aplicación de bupivacaina en el ganglio estrellado (GE) izquierdo o bilateral. Se hace por referencias anatómicas o guiado por ecografía. Es una medida temporal y que ha demostrado ser efectiva para reducir la carga de arritmia hasta en 90% a las 72 horas (20).
La DSC es una terapia que consiste en la remoción quirúrgica de la porción inferior del GE y los ganglios torácicos T2-T4. Se ha demostrado reducción en las descargas de CDI en pacientes con TE refractarias a otras terapias, la DSC bilateral es levemente superior a la izquierda aislada. Es una herramienta útil particularmente en pacientes con SQTL y TVPC (1, 5, 19).
Soporte hemodinámico: Debe considerarse de manera temprana en pacientes inestables cuando las otras terapias han fallado. La circulación extracorpórea y oxigenación con membrana (ECMO) puede ser utilizada de manera transitoria por días o semanas hasta que el tejido miocárdico se estabilice, se suspenda la noxa o se tomen decisiones adicionales. El ECMO puede ser útil para disminuir la cantidad de soporte con catecolaminas que a su vez pueden precipitar y perpetuar TE (17).
Se ha propuesto recientemente el uso del puntaje de riesgo PAINESD para identificar pacientes con arritmias ventriculares que serán sometidos a AC y que requieran soporte hemodinámico mecánico (21); esta estrategia ha demostrado lograr que los procedimientos de AC se cumplan hasta en el 92% de los pacientes, lograr no inducción de TV hasta en el 69% y una supervivencia a los 21 meses de seguimiento en el 90% (17).
Situaciones especiales:
* TV/FV idiopáticas: En ocasiones están relacionadas con CVP originadas en los tractos de salida o músculos papilares. Por el mecanismo de producción (Postdespolarizaciones tardías) las CVP pueden responder a adenosina o verapamilo. La taquicardia ventricular fascicular se reconoce por su excelente respuesta al verapamilo.
* Síndrome de Brugada: EL manejo médico en estos pacientes puede incluir infusiones de isoproterenol en contexto agudo. La quinidina puede usarse a largo plazo, y en pacientes con SdeB y síndrome de repolarización precoz puede usarse cilostazol.
* Síndrome de QT largo: Siempre es necesario disminuir la exposición a los desencadenantes como el ejercicio, estrés emocional, sonidos fuertes, entre otros. Los βB y la flecainida representan el manejo de elección, en quienes tienen recurrencia de AV se considera la DSC izquierda o bilateral.
*Síndrome de QT corto: La quinidina es el único antiarrítmico con beneficio en este escenario. Es frecuente que se acompañe de FA y se puede buscar controlar el ritmo con propafenona.
* Taquicardia ventricular polimórfica catecolaminérgica: Su manejo es similar al SQTL, con βB y la flecainida como estrategias farmacológicas y DSC como opción en casos refractarios.
* Cardiomiopatía arritmogénica del ventrículo derecho: Evitar el ejercicio es la primera estrategia preventiva. En pacientes con AV recurrentes puede considerarse la AC.
Manejo a largo plazo: Rápidamente debe tomarse la decisión de implantar un CDI en quienes aún no lo tienen y cumplen con las indicaciones definidas por las guías, siempre deben resolverse las noxas desencadenantes antes del egreso hospitalario.

Figura 3: Algoritmo de manejo para pacientes con tormenta eléctrica.
AET: Anestesia epidural torácica, AV: arritmias ventriculares, BPGE: Bloqueo percutáneo de ganglio estrellado, BCPA: Balón de contrapulsación aórtica, CVP: Contracciones ventriculares prematuras, DAVI: Dispositivos de asistencia ventrículo izquierdo, ECMO: circulación extracorpórea y oxigenación con membrana, IC: Insuficiencia cardiaca, FV: Fibrilación ventricular, SdeB: Síndrome de Brugada, SQTL: Síndrome de QT largo, TV: Taquicardia ventricular, TVM: taquicardia ventricular monomórfica, TVPM: Taquicardia ventricular polimórfica.
Modificado de Kowlgi GN, Cha YM. Management of ventricular electrical storm: a contemporary appraisal. Europace. 2020;22(12):1768-80 (5)
Conclusión:
El artículo de Kowlgi y Cha nos da una amplia visión de la TE como una condición de inestabilidad eléctrica miocárdica que triplica el riesgo de desenlaces adversos cardiovasculares importantes como mortalidad y descompensación de falla cardiaca. A lo largo de la misma se identifica los principales factores asociados con la fisiopatología de la TE, el reconocimiento y corrección de casusas desencadenantes, y termina con un algoritmo donde se resalta la importancia del manejo rápido y multidisciplinario de los pacientes que presentan este cuadro clínico.
Son múltiples las perspectivas futuras con respecto a la TE, dentro de ellas el ajuste de la definición, la aparición de nuevas estrategias farmacológicas e intervencionistas que permitan mejorar el desenlace a largo plazo de estos pacientes.
REFERENCIAS
1.Geraghty L, Santangeli P, Tedrow UB, Shivkumar K, Kumar S. Contemporary Management of Electrical Storm. Heart Lung Circ. 2019;28(1):123-33.
2.Pedersen CT, Kay GN, Kalman J, Borggrefe M, Della-Bella P, Dickfeld T, et al. EHRA/HRS/APHRS expert consensus on ventricular arrhythmias. Heart Rhythm. 2014;11(10):e166-96.
3.Exner DV, Pinski SL, Wyse DG, Renfroe EG, Follmann D, Gold M, et al. Electrical storm presages nonsudden death: the antiarrhythmics versus implantable defibrillators (AVID) trial. Circulation. 2001;103(16):2066-71.
4.Al-Khatib SM, Stevenson WG, Ackerman MJ, Bryant WJ, Callans DJ, Curtis AB, et al. 2017 AHA/ACC/HRS Guideline for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation. 2018;138(13):e272-e391.
5.Kowlgi GN, Cha YM. Management of ventricular electrical storm: a contemporary appraisal. Europace. 2020;22(12):1768-80.
6.Vergara P, Tung R, Vaseghi M, Brombin C, Frankel DS, Di Biase L, et al. Successful ventricular tachycardia ablation in patients with electrical storm reduces recurrences and improves survival. Heart Rhythm. 2018;15(1):48-55.
7.Credner SC, Klingenheben T, Mauss O, Sticherling C, Hohnloser SH. Electrical storm in patients with transvenous implantable cardioverter-defibrillators: incidence, management and prognostic implications. J Am Coll Cardiol. 1998;32(7):1909-15.
8.Bansch D, Bocker D, Brunn J, Weber M, Breithardt G, Block M. Clusters of ventricular tachycardias signify impaired survival in patients with idiopathic dilated cardiomyopathy and implantable cardioverter defibrillators. J Am Coll Cardiol. 2000;36(2):566-73.
9.Guerra F, Shkoza M, Scappini L, Flori M, Capucci A. Role of electrical storm as a mortality and morbidity risk factor and its clinical predictors: a meta-analysis. Europace. 2014;16(3):347-53.
10.Tsuji Y, Heijman J, Nattel S, Dobrev D. Electrical storm: recent pathophysiological insights and therapeutic consequences. Basic Res Cardiol. 2013;108(2):336.
11.Stevenson WG. Ventricular scars and ventricular tachycardia. Trans Am Clin Climatol Assoc. 2009;120:403-12.
12.Vaseghi M, Shivkumar K. The role of the autonomic nervous system in sudden cardiac death. Prog Cardiovasc Dis. 2008;50(6):404-19.
13.Napolitano C, Bloise R, Monteforte N, Priori SG. Sudden cardiac death and genetic ion channelopathies: long QT, Brugada, short QT, catecholaminergic polymorphic ventricular tachycardia, and idiopathic ventricular fibrillation. Circulation. 2012;125(16):2027-34.
14.Huang DT, Traub D. Recurrent ventricular arrhythmia storms in the age of implantable cardioverter defibrillator therapy: a comprehensive review. Prog Cardiovasc Dis. 2008;51(3):229-36.
15.Brigadeau F, Kouakam C, Klug D, Marquie C, Duhamel A, Mizon-Gerard F, et al. Clinical predictors and prognostic significance of electrical storm in patients with implantable cardioverter defibrillators. Eur Heart J. 2006;27(6):700-7.
16.Soar J, Bottiger BW, Carli P, Couper K, Deakin CD, Djarv T, et al. European Resuscitation Council Guidelines 2021: Adult advanced life support. Resuscitation. 2021;161:115-51.
17.Basu Ray I, Fendelander L, Singh JP. Cardiac resynchronization therapy and its potential proarrhythmic effect. Clin Cardiol. 2007;30(10):498-502.
18.Santangeli P, Muser D, Maeda S, Filtz A, Zado ES, Frankel DS, et al. Comparative effectiveness of antiarrhythmic drugs and catheter ablation for the prevention of recurrent ventricular tachycardia in patients with implantable cardioverter-defibrillators: A systematic review and meta-analysis of randomized controlled trials. Heart Rhythm. 2016;13(7):1552-9.
19.Bourke T, Vaseghi M, Michowitz Y, Sankhla V, Shah M, Swapna N, et al. Neuraxial modulation for refractory ventricular arrhythmias: value of thoracic epidural anesthesia and surgical left cardiac sympathetic denervation. Circulation. 2010;121(21):2255-62.
20.Tian Y, Wittwer ED, Kapa S, McLeod CJ, Xiao P, Noseworthy PA, et al. Effective Use of Percutaneous Stellate Ganglion Blockade in Patients With Electrical Storm. Circ Arrhythm Electrophysiol. 2019;12(9):e007118.
21.Mariani S, Napp LC, Lo Coco V, Delnoij TSR, Luermans J, Ter Bekke RMA, et al. Mechanical circulatory support for life-threatening arrhythmia: A systematic review. International journal of cardiology. 2020;308:42-9.









































1 Comment
Fernando de Quesada Lopez.
junio 30, 2021, 7:20 pmMe gustaría poder recibir otros artículos como este.
REPLY