Este interesante artículo publicado recientemente en el BMJ nos da un panorama completo y actualizado acerca de los mecanismos de acción a través de los cuales, los inhibidores del co-transportador sodio-glucosa tipo 2 (iSGLT2) actúan a nivel cardiovascular Introducción Durante los últimos años hemos sido testigos de los avances en el tratamiento de la insuficiencia
Este interesante artículo publicado recientemente en el BMJ nos da un panorama completo y actualizado acerca de los mecanismos de acción a través de los cuales, los inhibidores del co-transportador sodio-glucosa tipo 2 (iSGLT2) actúan a nivel cardiovascular
Introducción
Durante los últimos años hemos sido testigos de los avances en el tratamiento de la insuficiencia cardiaca, con nuevas moléculas que han logrado disminuir la mortalidad y hospitalizaciones en este grupo de pacientes; estudios como EMPA-REG OUTCOME y el DECLARE TIMI 58 demostraron una reducción de los desenlaces cardiovasculares (muerte, infarto no fatal, accidente cerebrovascular) y de las hospitalizaciones por insuficiencia cardiaca, con el uso de empagliflozina y dapagliflozina, respectivamente, en pacientes diabéticos y con enfermedad cardiovascular establecida. Lo más llamativo es que estudios posteriores (DAPA-HF y EMPEROR-Reduced) también demostraron reducción de estos desenlaces en el grupo de pacientes no diabéticos, lo que sugiere que estos beneficios son independientes del efecto hipoglicemiante.
Este interesante artículo publicado recientemente en el BMJ nos da un panorama completo y actualizado acerca de los mecanismos de acción a través de los cuales, los inhibidores del co-transportador sodio-glucosa tipo 2 (iSGLT2) actúan a nivel cardiovascular (1).
Insuficiencia cardiaca y diabetes
La insuficiencia cardíaca es un problema de salud pública, con una prevalencia estimada de 64.34 millones de casos en el mundo; el riesgo de presentarla incrementa con la edad y comorbilidades como la diabetes mellitus, hipertensión arterial y la obesidad. Las personas con diabetes tipo 2 tienen 2.5 veces más riesgo de desarrollar insuficiencia cardíaca que aquellas sin diabetes (1).
Algunos de los medicamentos usados para el tratamiento de la diabetes se han asociado con efectos cardiovasculares adversos; un metaanálisis que comparó varias estrategias hipoglicemiantes mostró que las tiazolidinedionas tuvieron un riesgo significativamente alto (RR 1.42, 95% IC 1.15-1.76) de desarrollar insuficiencia cardiaca; la saxagliptina, un inhibidor de la dipeptidil peptidasa 4, aumentó en un 27% el riesgo de hospitalizaciones por insuficiencia cardiaca, al igual que el uso de insulinas, con un 23% de aumento en el riesgo(2). En respuesta a la preocupación acerca del incremento del riesgo cardiovascular con algunos medicamentos hipoglicemiantes, las agencias reguladoras de Estados Unidos y Europa exigieron estudios de seguridad cardiovascular para todas las nuevas moléculas, a partir de 2008.
Terapia con iSGLT2
La proteína SGLT2, localizada en el túbulo contorneado proximal de la nefrona, es responsable de la reabsorción de 90% de la glucosa filtrada por el riñón. La inhibición del SGLT2 resulta en glucosuria (y natriuresis), disminuyendo así las concentraciones plasmáticas de glucosa.
Los iSGLT2 se asocian con una disminución del 30 – 35% en el riesgo de hospitlización por insuficiencia cardiaca, mientras que otros hipoglicemiantes más potentes han fallado en reducir el riesgo cardiovascular, particularmente en lo que respecta a los desenlaces en insuficiencia cardiaca. Mas aún, aunque la eficacia hipoglicemiante de los iSGLT2 disminuye con bajas tasas de filtración glomerular, su beneficio cardiovascular se preserva. Todo esto implica que existen mecanismos de acción diferentes al control glicémico que explican el beneficio cardiovascular (3–5).
iSGLT2 y desenlaces cardiovasculares
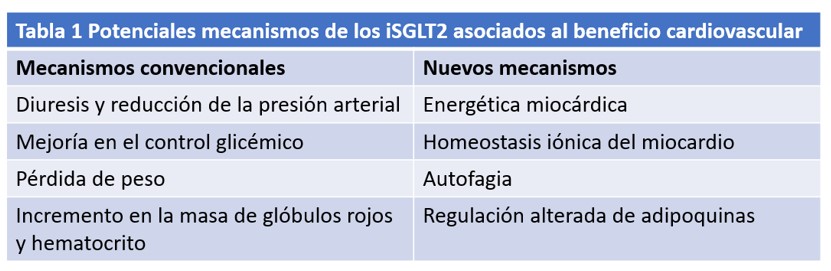
Como se ha mencionado previamente, los iSGLT2 han demostrado mejorar los desenlaces en la insuficiencia cardiaca. La reducción en las hospitalizaciones fue observada en pocos meses a la aleatorización, sugiriendo un mecanismo o efecto diferente a los otros hipoglicemiantes, cuyos beneficios cardiovasculares toman años en manifestarse. Luego de los resultados de los estudios pivotales, se diseñó el DAPA-HF trial (6), para evaluar la eficacia de los iSGLT2 en pacientes con insuficiencia cardiaca y fracción de eyección reducida, independiente de la presencia o ausencia de diabetes. Este estudio mostró que la dapagliflozina redujo en un 26% el riesgo de empeoramiento de la insuficiencia cardiaca o muerte de causa cardiovascular, independiente de la presencia de diabetes. Más recientemente, los resultados del EMPEROR-Reduce trial (7) mostraron que la empagliflozina también reduce el compuesto de muerte cardiovascular y hospitalización por insuficiencia cardiaca en pacientes con insuficiencia cardiaca con fracción de eyección reducida independiente de la presencia de diabetes. En ambos estudios, el desenlace primario fue arrastrado principalmente por la reducción de las hospitalizaciones por insuficiencia cardiaca y estos beneficios parecen ser un efecto de clase. En la tabla 1 se exponen los mecanismos propuestos asociados al beneficio cardiovascular.
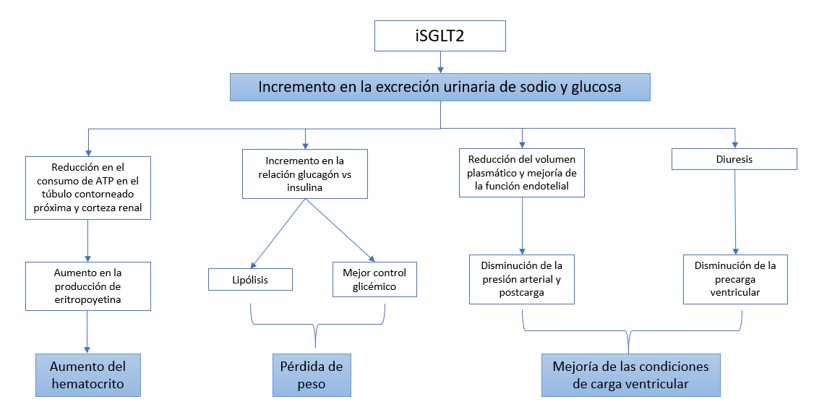
Mecanismos convencionales del beneficio de los iSGLT2 (figura 1)
Figura 1: Mecanismos convencionales del beneficio de los iSGLT2. Modificado de: Joshi SS, Singh T, Newby DE, et al Sodium-glucose co-transporter 2 inhibitor therapy: mechanisms of action in heart failure Heart Published Online First: 26 February 2021
Efecto diurético y antihipertensivo
Se ha sugerido que los iSGLT2 mejoran los desenlaces cardiovasculares debido a su efecto diurético y a la reducción de la presión arterial; estos medicamentos causan diuresis osmótica debido a glucosuria y natriuresis, la cual es dependiente de la concentración de glucosa plasmática, lo que no explica el beneficio observado en pacientes normoglicémicos con insuficiencia cardiaca en ausencia de diabetes mellitus. Aunque los iSGLT2 se asocian con natriuresis y disminución del volumen plasmático, es poco claro si este beneficio es sostenido, pues no se han encontrado diferencias en las concentraciones de NT-proBNP en pacientes con insuficiencia cardiaca crónica estable, a pesar de la mejoría clínica. Otro aspecto interesante, es que no se evidenció una reducción en la dosis de diurético entre los participantes durante el seguimiento del DAPA-HF. Recientes estudios han demostrado diferencias importantes entre el efecto diurético de los iSGLT2 y los diuréticos de asa; los primeros tienen poco efecto en el volumen plasmático, mientras que los diuréticos de asa se asocian con una reducción del volumen intravascular (7–9).
Por otro lado, se pensaba que el efecto antihipertensivo de los iSGLT2 era secundario a la diuresis y natriuresis, sin embargo, dado que este efecto se preserva incluso cuando declina la tasa de filtración glomerular, se ha sugerido que probablemente esté explicado por una mejoría en la función endotelial, reducción de la rigidez arterial y cambios en la actividad simpática. El efecto antihipertensivo de los iSGLT2 es sutil (2.56/1.46 mmHg), por lo que improbable que explique por sí solo el gran impacto en la mortalidad y morbilidad cardiovascular (10).
Reducción de peso y mejoría del control glicémico
La pérdida de peso (2.7 kg aproximadamente en pacientes diabéticos y prediabéticos) ocurre por un incremento en la relación glucagón:insulina, lo que causa un incremento en la movilización de lípidos y se piensa que es uno de los mecanismos involucrados en la reducción de la mortalidad en insuficiencia cardiaca. Hasta la fecha, no hay evidencia que la terapia con iSTLT2 favorezca la pérdida de peso en los no diabéticos, lo que no explicaría los beneficios vistos en esta población. Por otro lado, está claramente establecido que un adecuado control glicémico impacta de forma positiva en los desenlaces cardiovasculares, principalmente a largo plazo (11).
Incremento en el hematocrito
La terapia con iSGTL2 está asociada con un incremento en la producción renal de eritropoyetina, masa eritrocitaria y hematocrito. Tales cambios pueden contribuir a la mejoría en los desenlaces cardiovasculares, aunque un incremento similar ha sido reportado con darbepoetina alfa sin un beneficio en la mortalidad en pacientes con disfunción sistólica (12). El efecto de los iSGLT2 en este dominio no puede explicar por si solo el beneficio observado en insuficiencia cardiaca y las vías involucradas continúan siendo objeto de investigación.
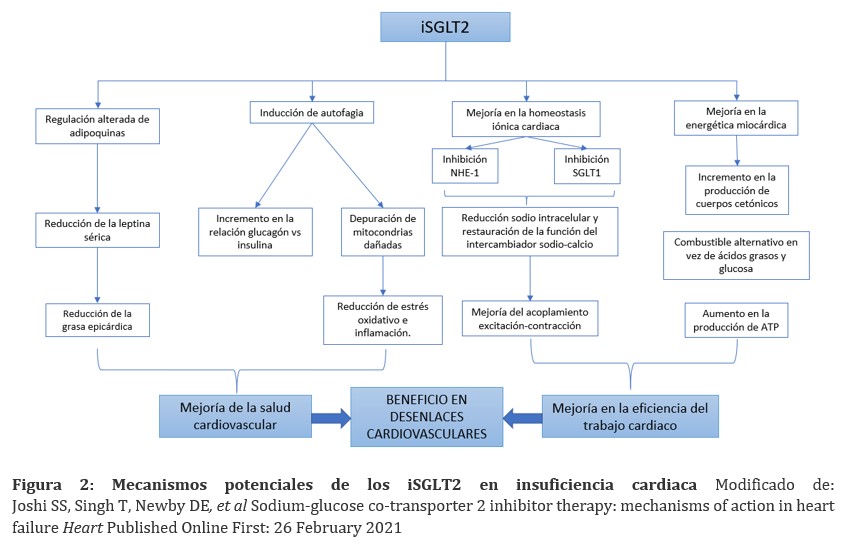
Mecanismos potenciales de los iSGLT2 en insuficiencia cardiaca (figura 2)
Efectos cardiacos directos
La hipertrofia ventricular, fibrosis e inflamación llevan a un remodelado patológico en la insuficiencia cardíaca y contribuye de forma importante en su gravedad. Algunos estudios pre-clínicos y clínicos han demostrado un rol de la terapia con iSGLT2 en el remodelado reverso. Se ha observado este efecto en pacientes con diabetes tipo 2 e hipertrofia ventricular izquierda, pero no ha sido vista en pacientes con insuficiencia cardíaca; esto aumenta la posibilidad que, en el contexto de insuficiencia cardíaca, los iSGLT2 puedan tener efectos directos cardioprotectores, más allá de la sobrecarga ventricular y el remodelado (13).
Mejoría en la energética miocárdica
Bajo condiciones fisiológicas, cerca del 90% de la enérgica cardíaca es derivada del metabolismo oxidativo mitocondrial y el combustible es derivado de ácido grasos libres, glucosa y en menor cantidad de lactato, cetonas y aminoácidos. En la diabetes tipo 2 o en la insuficiencia cardiaca existe una desregulación en la oxidación de ácidos grasos y en la recaptación de glucosa, lo que se asocia a disfunción miocárdica. En este contexto de baja reserva energética, los cuerpos cetónicos son un “super combustible” que producen ATP de forma más eficiente que la glucosa o los ácidos grasos libres. La terapia con iSGLT2 incrementa la síntesis hepática de cetonas y disminuye su excreción urinaria, produciendo un estado persistente y leve de hipercetonemia. Bajo estas condiciones, el beta-hidroxibutirato es tomado libremente por el corazón y el riñón y se oxida con preferencia a los ácidos grasos y la glucosa. Se ha hipotetizado que el beneficio cardiovascular de los iSGLT2 puede estar relacionado con el cambio en el metabolismo miocárdico, mejorando así la eficiencia cardiaca (14).
Homeostasis iónica del miocardio
La homeostasis del calcio es fundamental para un eficiente acoplamiento excitación-contracción. En el contexto de diabetes tipo 2 e insuficiencia cardiaca, existe una regulación al alta del intercambiador sodio-hidrógeno tipo 1 y SGLT1, dando como resultado un incremento marcado en el sodio y calcio intracelular. El elevado contenido de calcio intracelular basal da como resultado una reducción del calcio transitorio y menos reservas de calcio en el retículo sarcoplásmico en los cardiomiocitos de pacientes diabéticos, lo que altera la función contráctil. La terapia con iSGLT2 reduce el contenido citosólico de sodio en modelos murinos, mejorando la homeostasis del calcio y contribuyendo así a los beneficios cardiovasculares (15). Se están adelantando estudios para validar estas hipótesis en humanos.
Autofagia
Es el proceso por el cual se mantiene el equilibrio fisiológico celular; estudios experimentales apoyan que la inducción de autofagia tiene efectos favorables en la insuficiencia cardiaca, ya que conduce a la eliminación eficiente de mitocondrias disfuncionales, que son una fuente importante de especies reactivas de oxígeno, que promueven el estrés oxidativo y la inflamación. Se ha propuesto que los iSGLT2 pueden inducir autofagia al simular el agotamiento de nutrientes por periodos de aumento del catabolismo debido a la glucosuria constante; este efecto podría explicar en parte los beneficios cardiovasculares asociados a la terapia con iSGLT2 (16).
Regulación de adipoquinas
La Leptina y la adiponectina son citoquinas producidas exclusivamente por los adipocitos. Estas adipoquinas son esenciales en la regulación de la ingesta de alimentos y la homeostasis energética; la Leptina está implicada en varias enfermedades cardiovasculares relacionadas con la obesidad, mientras que la adiponectina se considera cardioprotectora. Una de las teorías implicadas en la insuficiencia cardiaca es el depósito graso en el epicardio debido a una regulación alterada de estas adipoquinas; los iSGLT2 reducen la leptina sérica e incrementan las concentraciones de adiponectina, lo que potencialmente ofrecería cardioprotección (17).
Conclusión
Las vías exactas del beneficio cardiovascular de la terapia con iSGTL2 aún no se han logrado establecer y nuevas teorías continúan emergiendo. Es plausible que la inhibición del STLT2 interactúa con vías a nivel celular facilitando los beneficios cardiovasculares; sin duda, el efecto positivo en la insuficiencia cardiaca comprende mecanismos multifactoriales (convencionales y nuevos mecanismos potenciales). Existe una fuerte evidencia preclínica que la mejoría de la homeostasis iónica miocárdica tiene un papel importante en los beneficios cardiovasculares. Es fundamental comprender las vías a través de las cuales la terapia con iSGLT2 mejoran la salud cardiovascular, lo que nos ayudará a entender más la insuficiencia cardiaca y la miocardiopatía diabética, y desarrollar futuras terapias dirigidas a intervenir estas vías.
Ver link AQUI
REFERENCIAS
1)Joshi SS, Singh T, Newby DE, Singh J. Sodium-glucose co-transporter 2 inhibitor therapy: mechanisms of action in heart failure. Heart [Internet]. 2021 Feb 26;heartjnl-2020-318060. Available from: http://heart.bmj.com/content/early/2021/02/25/heartjnl-2020-318060.abstract
2)Udell JA, Cavender MA, Bhatt DL, Chatterjee S, Farkouh ME, Scirica BM. Glucose-lowering drugs or strategies and cardiovascular outcomes in patients with or at risk for type 2 diabetes: a meta-analysis of randomised controlled trials. Lancet Diabetes Endocrinol. 2015 May;3(5):356–66.
3)Cannon CP, Pratley R, Dagogo-Jack S, Mancuso J, Huyck S, Masiukiewicz U, et al. Cardiovascular Outcomes with Ertugliflozin in Type 2 Diabetes. N Engl J Med. 2020 Oct 8;383(15):1425–35.
4)Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2019 Jan 24;380(4):347–57.
5)Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015 Nov 26;373(22):2117–28.
6)McMurray JJV, Solomon SD, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019 Nov 21;381(21):1995–2008.
7)Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020 Oct 8;383(15):1413–24.
8)Nassif ME, Windsor SL, Tang F, Khariton Y, Husain M, Inzucchi SE, et al. Dapagliflozin Effects on Biomarkers, Symptoms, and Functional Status in Patients With Heart Failure With Reduced Ejection Fraction. Circulation. 2019 Oct 29;140(18):1463–76.
9)Sha S, Polidori D, Heise T, Natarajan J, Farrell K, Wang S-S, et al. Effect of the sodium glucose co-transporter 2 inhibitor canagliflozin on plasma volume in patients with type 2 diabetes mellitus. Diabetes, Obes Metab. 2014 Nov;16(11):1087–95.
10)Nakayama H, Ohtsuka Y, Kawahara M, Nakamura Y, Iwata S, Yoshinobu S, et al. Changes in body composition during SGLT2 inhibitor treatment and their relevance to the improvement of insulin sensitivity. Diabetes Res Clin Pract. 2016 Oct;120:S50–1.
11)Pinto L, Rados D, Remonti L, Kramer C, Leitao C, Gross J. Efficacy of SGLT2 inhibitors in glycemic control, weight loss and blood pressure reduction: a systematic review and meta-analysis. Diabetol Metab Syndr. 2015;7(Suppl 1):A58.
12)Swedberg K, Young JB, Anand IS, Cheng S, Desai AS, Diaz R, et al. Treatment of Anemia with Darbepoetin Alfa in Systolic Heart Failure. N Engl J Med. 2013 Mar 28;368(13):1210–9.
13)Shi L, Zhu D, Wang S, Jiang A, Li F. Dapagliflozin Attenuates Cardiac Remodeling in Mice Model of Cardiac Pressure Overload. Am J Hypertens. 2019 Apr 22;32(5):452–9.
14)Subodh V, Sonia R, L. HK, S. WC, Liyan Z, Hwee T, et al. Empagliflozin Increases Cardiac Energy Production in Diabetes. JACC Basic to Transl Sci [Internet]. 2018 Oct 1;3(5):575–87. Available from: https://doi.org/10.1016/j.jacbts.2018.07.006
15)Beuckelmann DJ, Näbauer M, Erdmann E. Intracellular calcium handling in isolated ventricular myocytes from patients with terminal heart failure. Circulation. 1992 Mar;85(3):1046–55.
16)Zhou H, Wang S, Zhu P, Hu S, Chen Y, Ren J. Empagliflozin rescues diabetic myocardial microvascular injury via AMPK-mediated inhibition of mitochondrial fission. Redox Biol. 2018 May;15:335–46.
17)Wu P, Wen W, Li J, Xu J, Zhao M, Chen H, et al. Systematic Review and Meta-Analysis of Randomized Controlled Trials on the Effect of SGLT2 Inhibitor on Blood Leptin and Adiponectin Level in Patients with Type 2 Diabetes. Horm Metab Res. 2019 Aug 13;51(08):487–94.








































Deje un comentario
Registrese para comentar. Sus e-mail no será publicados